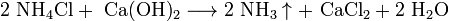Опыты: цветное пламя
Содержание:
Что собой представляет дым при пожаре
Каждый спасатель должен знать, что дым от возгорания – «аэрозоль», т. е. взвесь частиц (твердых, жидких) в газообразной среде. На основании этого утверждения делаются выводы о физических свойствах данной субстанции.
Особенности дыма:
- Стойкость (обеспечивается электростатическим зарядом разогретых частиц, который повышает концентрацию продуктов горения в процессе дальнейшего развития пожара).
- Способность к адсорбции паров и газов на своей поверхности (затрудняет видимость, действует удушающе).
- Повышение токсичности при увеличении температуры.
Таким образом, дым от пожара – смесь частиц, образующихся в результате горения материалов и веществ. И то, как именно он повлияет на человека, зависит от очага возгорания и распространения огня. На начальных этапах горения всегда есть шанс спасти людей, получивших некритическую дозу яда.
Характеристики
Любые задымления от пожаров характеризуют по цвету дыма, что делает возможным распознание горящих материалов. Согласно ГОСТ Р 54081-2010, оптические методы разведки («на глаз») используются так же эффективно, как и последующий анализ состава продуктов горения.
С течением времени свойства дыма изменяются, что говорит об изменении пожарной обстановки (знак для руководителя тушения возгорания о смене стратегии).
Основные характеристики дыма приводятся в таблице.
| Цвет задымления | Запах | Вкус | Предполагаемый вид горящего вещества (выделяемый газ) |
| Беловато-желтый (грязный) | Специфический | Кисловатый | Бумажные материалы, сено |
| Сероватый, черно-бурый, желтоватый | Неприятный, сернистый | В зависимости от материала (кисловатый) | Резина, клей (полимеры), волосы, кожа, шерсть |
| Серо-черный | Смолистый | Едкий, тяжелый | Дерево |
| Черный (коптящий) | Химический, нефтяной | Горький | Горючие жидкости и нефтепродукты (бензин, скипидар, керосин и т. д.) |
| Белый (плотный) | Чесночный либо сернистый (раздражающий) | Металлический либо вяжущий | Магний, фосфор, мышьяк, формальдегиды |
| Сиреневый | Сернистый | Кислый, резкий | Сера |
| Желто-бурый | Раздражающий | Кислый | Азотсодержащие вещества |
| Бурый | Специфический | Кисловатый | Ткань |
| Лимонный (иногда бесцветный) | Удушающий | Резкий, раздражающий | Хлор. При нахождении в помещении нагретого железа образуется рыжий дымок |
| Бесцветный | Сладкий | Сладковато-горький (миндальный) | Синильная кислота |
| Газ не получается видеть, чувствовать. Не обладает ни одной из перечисленных характеристик. | Оксид углерода | ||
| Бесцветный | Сладковатый | Миндальный | Сероводород |
| Красновато-бурый | Специфический | Резкий, едкий | Оксид азота (при взрывах) |
Молочные и разноцветные (нетипичные) оттенки дыма говорят о повышенной опасности ядов, которые проникают в организм как через дыхательные пути, так и кожу. Токсикологическое действие дыма в условиях города рассмотрено известным американским медиком Хейки Саволайнен (статья).
Состав
 Задымление.
Задымление.
Дым по химическому составу представляет собой смесь разнообразных газов. С учетом того, что воздух состоит из азота (78%) и кислорода (21%), на начальных этапах горения их концентрация будет существенно снижаться.
Увеличивается объем окисей за счет выделения в процессе горения углекислого газа. Химическая формула дыма в конечном счете будет зависеть от концентрации газов и продуктов горения, а также их соотношения.
Пламя в условиях невесомости
В условиях, когда ускорение свободного падения компенсируется центробежной силой, например, при полёте по орбите земли, горение вещества выглядит несколько иначе. Поскольку ускорение свободного падения компенсировано, сила Архимеда практически отсутствует. Таким образом, в условиях невесомости горение веществ происходит у самой поверхности вещества (пламя не вытягивается), а сгорание более полное. Продукты горения постепенно равномерно распространяются в среде. Это весьма опасно для систем вентилирования. Также серьёзную опасность представляют пудры, поэтому в космосе порошкообразные материалы не применяются нигде, кроме специальных опытов именно с порошками.
В струе воздуха пламя вытягивается и принимает привычный облик. Пламя газовых горелок благодаря давлению газа в условиях невесомости внешне также не отличается от горения в земных условиях.
Пламя в невесомости
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой
Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
- При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
- Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
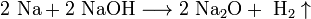
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22−и надпероксид-ион O2−.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Формула кислородного соединения |
Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
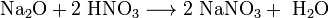
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
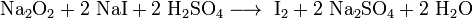
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
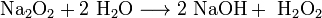

3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:

При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
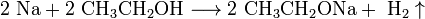
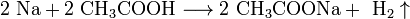
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
Окраска пламени щелочными металлами
и их соединениями
| Щелочной металл | Цвет пламени |
|---|---|
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Бурокрасный |
| Cs | Фиолетово-красный |
Температура пламени
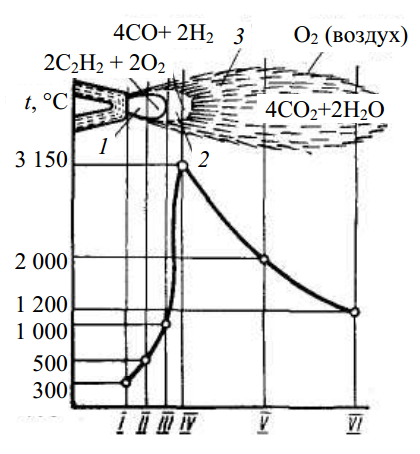
Для разных горючих паров и газов температура пламени неодинакова. А ещё неодинакова температура разных частей пламени, а область полного сгорания имеет более высокие показатели температуры.
Некоторое количество горючего вещества при сжигании выделяет определённое количество теплоты. Если строение вещества известно, то можно рассчитать объём и состав полученных продуктов горения. А если знать удельную теплоту этих веществ, то можно рассчитать ту максимальную температуру, которую достигнет пламя.
Стоит помнить о том, что если вещество горит в воздухе, то на каждый объём вступающего в реакцию кислорода приходится четыре объёма инертного азота. А так как в пламени присутствует азот, он нагревается теплотой, которая выделяется при реакции. Исходя из этого можно сделать вывод о том, что температура пламени будет состоять из температуры продуктов горения и азота.
Невозможно точно определить температуру, но можно это сделать приблизительно, так как удельная теплота изменяется с температурой.
Вот некоторые показатели по температуре открытого огня в разных материалах.
- Горение магния — 2200 градусов.
- Горение спирта не превышает температуры 900 градусов.
- Горение бензина — 1300−1400 градусов.
- Керосина — 800, а в среде чистого кислорода — 2000 градусов.
- Горение пропан-бутана может достигать температуры от 800 до 1970 градусов.
- При сгорании дерева температурный показатель колеблется от 800 до 1000 градусов, а воспламеняется оно при 300 градусах.
- Температурный параметр горения спички составляет 750−850 градусов.
- В горящей сигарете — от 700 до 800 градусов.
- Большинство твёрдых материалов воспламеняется при температурном показателе в 300 градусов.
Это интересно
Поговорим немного об огненных красителях?
Бывает невидимое пламя, а бывает и яркое цветное. Например, водород горит совершенно бесцветным пламенем, как и чистый спирт, а вот обычная свеча или костер горят и освещают пространство вокруг себя. Получается, яркость любого пламени определяет наличие раскаленных твердых частиц.
Некоторые металлы и соли металлов добавляют в пламя, чтобы окрасить его в определенный цвет. Высокая температура временно переводит электроны отдельных ионов этих металлов и солей в более высокое состояние энергии. Когда электроны в ионах возвращаются к своему исходному состоянию, они испускают свет с определенной длиной волны. Так и получается пламя разных цветов. Например:
Оранжевое пламя — хлорид натрия
Красное пламя — хлорид кальция
Светло-фиолетовое пламя — хлорид калия
Голубое пламя — сульфат меди
Синее пламя — хлорид меди или селена
Светло-зеленое пламя — бура́ (тетраборат натрия)
Розовое пламя — хлорид стронция
Ярко-алое пламя — хлорид лития
Важно отметить, что цвет пламени зависит от металла-катиона, а анион соли практически никакого влияния на это не оказывает. Этим свойством ионов некоторых металлов пользуются для того, чтобы создавать разноцветное пламя, например, в пиротехнике
Соединения щелочных металлов
Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
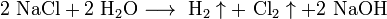
катод:
анод:
- Прежде щёлочь получали реакцией обмена:
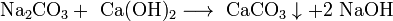
Получаемая таким способом щёлочь была сильно загрязнена содой Na2CO3.
Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
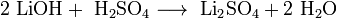
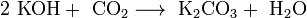
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
Карбонаты
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26 — 30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
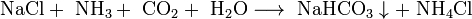
- Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3−, необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону:
- Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
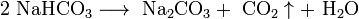
Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действием углекислого газа на раствор гидроксида калия:
Поташ используют в производстве стекла и жидкого мыла.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO3−.
Цвет пламени
различный вид горелки Бунзена зависит от притока кислорода:1. богатая топливная смесь без предварительного смешивания с кислородом (подача кислорода закрыта) горит жёлтым коптящим рассеянным пламенем2. подача воздуха снизу почти перекрыта3. открыта в средней мере: смесь близка к стехиометрической4. подача воздуха максимальная: бедная смесь
Цвет пламени определяется излучением электронных переходов (например, тепловым излучением) различных возбужденных (как заряженных, так и незаряженных) частиц, образующихся в результате химической реакции между молекулами горючего и кислородом воздуха, а также в результате термической диссоциации. В частности, при горении углеродного горючего в воздухе, синяя часть цвета пламени обусловлена излучением частиц CN±n, красно-оранжевая — излучением частиц С2±n и микрочастиц сажи. Излучение прочих образующихся в процессе горения частиц (CHx±n, H2O±n, HO±n, CO2±n, CO±n) и основных газов (N2, O2, Ar) лежит в невидимой для человеческого глаза УФ и ИК части спектра. Кроме того, на окраску пламени сильно влияет присутствие в самом топливе, деталях конструкции горелок, сопел и так далее соединений различных металлов, в первую очередь натрия. В видимой части спектра излучение натрия крайне интенсивно и ответственно за оранжево-желтый цвет пламени, при этом излучение чуть менее распространенного калия оказывается на его фоне практически не различимым (поскольку большинство организмов имеют в составе клеток K+/Na+ каналы, то в углеродном горючем растительного или животного происхождения на 3 атома натрия приходится в среднем 2 атома калия).
Горение металлов
По характеру горения металлов их делят на две группы: летучие и нелетучие. Летучие металлы обладают относительно низкими температурами фазового перехода — температура плавления менее 1000 К, температура кипения не превышает 1500 К. К этой группе относятся щелочные металлы (литии, натрий, калий и др.) и щелочноземельные (магний, кальций). Температуры фазового перехода нелетучих металлов значительно выше. Температура плавления, как правило, выше 1000 К. а температура кипения — больше 2500 К (табл. 1).
Механизм горения металлов во многом определяется состоянием их окисла. Температура плавления летучих металлов значительно ниже температуры плавления их окислов. При этом последние представляют собой достаточно пористые образования.
При поднесении источника зажигания к поверхности металла происходит его испарение и окисление. При достижении концентрации паров, равной нижнему концентрационному пределу, происходит их воспламенение. Зона диффузионного горения устанавливается у поверхности, большая доля тепла перелается металлу, и он нагревается до температуры кипения. Образующиеся пары, свободно диффундируя через пористую окисную пленку, поступают в зону горения. Кипение металла вызывает периодическое разрушение окисной пленки, что интенсифицирует горение. Продукты горения (окислы металлов) диффундируют не только к поверхности металла, способствуя образованию корки окисла, но и в окружающее пространство, где, конденсируясь, образуют твердые частички в виде белого дыма. Образование белого плотного дыма является визуальным признаком горения летучих металлов.
У нелетучих металлов, обладающих высокими температурами фазового перехода, при горении на поверхности образуется весьма плотная окисная пленка, которая хорошо сцепляется с поверхностью металла. В результате этого скорость диффузии паров металла через пленку резко снижается и крупные частицы, например, алюминия и бериллия, гореть не способны. Как правило, пожары таких металлов имеют место в том случае, когда они находятся в виде стружки, порошков и аэрозолей. Их горение происходит без образования плотного дыма. Образование плотной окисной пленки на поверхности металла приводит к взрыву частицы. Это явление особенно часто наблюдается при движении частицы в высокотемпературной окислительной среде, связывают с накоплением паров металлов под окисной пленкой с последующим внезапным ее разрывом. Это, естественно, приводит к резкой интенсификации горения.
Основными параметрами их горения являются время воспламенения и сгорания. Из теории диффузионного горения следует, что время сгорания частицы металла tг пропорционально квадрату ее диаметра do. Экспериментальные данные показывают, что фактическая зависимость несколько отличается от теоретической. Так, для алюминия tг
Повышение концентрации кислорода в атмосфере интенсифицирует горение металла. Частички алюминия диаметром (53 ÷ 66) 10 -3 мм в атмосфере, содержащей 23% кислорода, сгорают за 12,7·10 -3 с, а при повышении концентрации окислителя до 60% — за 4,5·10 -3 с.
Однако для пожарно-технических расчетов большой интерес представляет не время сгорания частицы металла, а скорость распространения пламени по потоку взвеси частиц металла в окислителе. В табл.2 приведены экспериментальные данные по скорости распространения пламени и массовой скорости выгорания взвеси частиц диаметрами менее 10 -2 мм и 3·10 -2 мм алюминия в воздухе при различном коэффициенте избытка воздуха.
Классификация пламени
Классифицируют свечение огня следующим образом.
- По восприятию визуальному: цветные, прозрачные, коптящие.
- По высоте: короткие и длинные.
- По скорости распространения: быстрые и медленные.
- По температурному показателю: высокотемпературные, низкотемпературные, холодные.
- По характеру перемещения среды реакционной: пульсирующие, турбулентные, ламинарные.
- По состоянию горючей среды: предварительно перемешанные и диффузионные.
- По излучению: бесцветные, окрашенные, светящиеся.
- По агрегатному состоянию горючих веществ: пламя аэродисперсных и твёрдых реагентов, жидких и газообразных.
В диффузном ламинарном пламени выделяют три оболочки (зоны). Внутри конуса пламени существует:
- зона тёмная, где нет горения из-за малого количества окислителя — 300−350 градусов;
- зона светящаяся, где осуществляется термическое разложение горючего и оно сгорает частично — 500−800 градусов;
- зона слегка светящаяся, где окончательно сгорают продукты разложения горючего и достигается максимальный температурный показатель в 900−1500 градусов.
Температурный параметр пламени зависит от интенсивности подвода окислителя и природы горючего вещества. Пламя распространяется по предварительно перемешанной среде. Происходит распространение по нормали от каждой точки фронта к поверхности пламени.
По реально существующим смесям газовоздушным распространение всегда осложнено возмущающими внешними воздействиями, которые обусловлены трением, конвективными потоками, силами тяжести и прочими факторами.
Именно из-за этого реальная скорость распространения от нормальной всегда отличается. В зависимости от того, какой характер носит скорость распространения, различают такие диапазоны:
- При горении детонационном — более 1000 метров в секунду.
- При взрывном — 300−1000.
- При дефлаграционном — до 100.
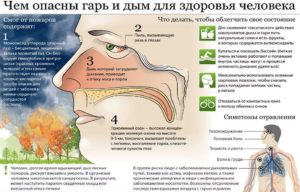
Влияние дыма на организм человека
Дым и смог небезопасны даже в условиях лесных пожаров на открытых местностях. Яды, выделяемые в процессе горения, оказывают токсичное (смертельное) действие на все органы человека.
Несмотря на то что восстановить состояние до нормы удается в течение первых суток, выводить системные яды приходится несколько дней или даже недель. Иногда требуется пройти полное клиническое обследование, например, при хронических болезнях легких, сердца и печени.
Ситуация усложняется тем, что когда человек сталкивается с удушающими газами, он непременно открывает окна, чтобы почувствовать себя лучше. Однако, такая тактика недальновидна. Тело, испытывающее кислородное голодание (неполное обогащение крови), еще может трезво соображать и действовать рефлекторно.
Однако, получив глоток свежего воздуха, организм расширяет распространение яда, клеточный обмен ускоряет свой цикл, и все токсины, пока еще не поглощенные клетками, наносят «роковой» удар. Люди мгновенно падают в обморок и спасает их только экстренная госпитализация.
Кожный покров и слизистые оболочки
Оксид углерода (угарный газ) выделяется при пожарах в больших объемах, причем вне зависимости от того, какой материал горит – дерево, нефтепродукты или ткань. Он сам себя воспроизводит, когда огонь достигает нетронутого участка квартиры. Все дело в меньшей температуре объекта по сравнению с газовым облаком пламени.
Углекислый газ раздражает носоглотку (кашель, першение) и блокирует тканевое дыхание, так как связывается с гемоглобином. Человек начинает вдыхать воздух ртом, что приводит к еще большим последствиям. Длительное нахождение в помещении, заполненном оксидом, заканчивается летально.
Лесные пожары в еще большей степени разрушают слизистую – концентрированный газ при сжигании смол вызывает остановку сердца и печеночную недостаточность.
В основном дым действует на кожные покровы незаметно для человека. Может появиться жжение или чесотка. При вдыхании паров наиболее часто случаются небольшие ожоги носоглотки, воспаления глаз.
Однако, при наличии опасных для жизни ядов ситуация прямо противоположная – появляется сильная резь в глазах, временная слепота, отек носа и горла. Индивидуальная непереносимость приводит к обострению аллергии, развитию хронической астмы.
Органы и функция дыхания
Основной удар от дыма принимают на себя легкие. В их капиллярах скапливается большое количество вдыхаемых газов. Так как кислорода становится все меньше, а функция дыхания производится постоянными циклами (вплоть до остановки сердца), человек получает сильное отравление.
Кровь разносит токсичные соединения по всему организму, появляются боли не только в груди, но и в мышцах. Поэтому пострадавшим делают комплекс процедур – сердечно-легочную реанимацию и инъекционные процедуры.
 Воздействие дыма на человека.
Воздействие дыма на человека.
Первые симптомы отравления дымом проявляются в виде учащения дыхания и жжения в горле. Объема воздуха, вдыхаемого через нос, становится недостаточно.
Далее проявляется больший отек носоглотки, возникает приступ удушья, который доходит до полуобморочной стадии. После потери сознания дыхание осуществляется самопроизвольно. Без защитной повязки человек не продержится и 5 минут, даже если очаг возгорания находится на нижнем этаже или в подвале.
Многие из веществ становятся причиной бронхитов, ларингитов, отека легких, застоя крови в альвеолах.
Кровь
Дым разрушает часть красных кровяных телец, за счет чего кислородный обмен замедляется. Изменяется и состав плазмы. Развивается малокровие, давление резко снижается. В качестве веществ, парализующих функцию эритроцитов, называют бензольные соединения (ксилол, нитриты, толуол), оксид углерода, свинец и «смертельные» яды.
Нервная система
Дым воздействует на нервную систему избирательно и только в случае присутствия в газах нервно-паралитических (психотропных) или отравляющих веществ.
Действия химических соединений при попадании в организм различаются – одни притупляют сознание (сонливость, головокружение, боль, «сладкая» смерть), другие стимулируют.
Окраска — пламя
Окраска пламени также дает указание. Однако при этом следует иметь в виду, что желтое натриевое пламя может быть вызвано уже следами натрия.
Окраска пламени обусловлена присутствием бора, находящегося в борноэтиловом эфире. Борноэтиловый эфир образуется в результате взаимодействия борной кислоты с этиловым спиртом.
Окраска пламени также дает указание. Однако при этом следует иметь в виду, что желтое натриевое пламя может быть вызвано уже следами натрия.
Окраска пламени от соединений калия красно-фиолетовая.
Окраска пламени от соединений лития ярко-красная.
Окраска пламени объясняется образованием летучих при высокой температуре галогенидов меди. Эта проба чрезвычайно чувствительна, и положительный ее результат может быть обусловлен наличием в исследуемом веществе лишь следов примесей, содержащих галоген. Этим путем легко обнаруживается, например, хлор в слюне.
Окраска пламени Rb — красный; Cs — голубой; Be — не окрашивает; Mg — ослепительно белый; Са — кирпично-красный; Sr — малиновый, Ва — яблочно-зеленый.
Наилучшую окраску пламени дают хлораты и перхлораты, так как продукты их разложения — хлориды — наиболее легко диссоциируемы и летучи.
Эта окраска пламени обусловливается тем, что вещество, внесенное в пламя горелки, термически диссоциирует при высокой температуре ( 2000 — 3000 К) на свободные атомы, которые излучают свет, с определенным для каждого элемента набором длин волн. Цвет света зависит от длины волны. Наибольшая длина волны видимого света соответствует красному цвету, наименьшая — фиолетовому. Метод, основанный на изучении спектра паров исследуемого вещества, называют спектральным анализом. В качественном спектральном анализе суммарное излучение каждого элемента разделяется в пространстве по длинам волн в специальных оптических приборах. Полученное в них излучение источника света, разложенное по длинам волн, называют линейчатым спектром.
Для окраски пламени в синий цвет применяются некоторые соли меди, например, углекислая медь СиС03; она представляет собой светлозеленые кристаллы, нерастворимые в воде.
Эта окраска пламени характерна для алкилгалогенидов.
Отмечают окраску пламени, степень горючести образца, плавится он или нет, а также запах продуктов горения.
Какую окраску пламени дает борная кислота.
По окраске пламени горелки — темно-красная для Sr, светло-зеленая для Ва.
Особенно характерна окраска пламени летучими солями щелочных и щелочноземельных металлов. Минерал в виде осколка пинцетом вводится в пламя спиртовки или паяльной трубки. Минералы неплавкие или тугоплавкие смачивают соляной кислотой. В табл. 12 показано окрашивание пламени отдельными элементами.
Часто задаваемые вопросы
У меня не получается вставить носик в баночку.
Попробуйте с другим носиком. Постарайтесь вставить его в баночку так, чтобы он в ней плотно сидел. Разумеется, вы можете попросить помощи у взрослого.
А я могу использовать обычную фольгу для проведения опыта?
Если вы внимательно посмотрите, то увидите, что фольга в наборе несколько плотнее, чем обычная фольга. По этой причине ее не стоит заменять на какую-либо другую. Фольги в наборе должно быть достаточно для проведения опыта несколько раз.
У меня не получается высыпать сухое горючее из баночки.
Перемешайте сухое горючее в баночке при помощи деревянной палочки. Так вы сможете разбить комочки и насыпать на фольгу требуемое количество горючего.
Как лучше высыпать металлические порошки в пламя?
Направьте носик баночки на пламя под углом 30–40 градусов. Легонько постучите по баночке, чтобы порошок начал высыпаться. Если это не помогает, сделайте угол наклона поострее и постучите по баночке посильнее.