Hf
Содержание:
Токсичные свойства
Плавиковая кислота пожаро- и взрывобезопасна; чрезвычайно ядовита. Возможны острые и хронические отравления с изменением крови и кроветворных органов, органов пищеварительной системы, отёк лёгких.
Обладает выраженным эффектом при вдыхании, раздражающим действием на кожу и слизистые оболочки глаз (вызывает болезненные ожоги и изъязвления); кожно-резорбтивным, эмбриотропным, мутагенным и кумулятивным действием. Ей присвоен второй класс опасности для окружающей среды; чистый фтороводород также принадлежит ко второму классу опасности.
При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие. Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу.
При попадании в кровь через кожу связывает кальций крови и может вызвать нарушение сердечной деятельности. Ожоги площадью более чем 160 см2 опасны возможными системными токсическими проявлениями.
Токсичность плавиковой кислоты и её растворимых солей, предположительно, объясняется способностью свободных ионов фтора связывать биологически важные ионы кальция и магния в нерастворимые соли (). Поэтому для лечения последствий воздействия плавиковой кислоты часто используют глюконат кальция, как источник ионов Ca2+. Пострадавшие участки при ожогах плавиковой кислотой промываются водой и обрабатываются 2,5 % гелем глюконата кальция. Тем не менее, поскольку кислота проникает сквозь кожу, простого промывания недостаточно и необходимо обращение к врачу для проведения лечения. Высокую эффективность показали внутриартериальные инфузии хлорида кальция.
Предельно допустимая концентрация (ПДК) плавиковой кислоты:
| Вид | ПДК максимально разовая (ПДКм. р.) | ПДК среднесуточная (ПДКс. с.) |
|---|---|---|
| ПДК в воздухе рабочей зоны, мг/м³ (в пересчёте на ионы фтора) | 0,5 | 0,1 |
| ПДК в атмосферном воздухе, мг/м³ (в пересчёте на ионы фтора) | 0,02 | 0,005 |
Получение фтористого водорода.
Непосредственное соединение
фтора с водородом сопровождается
значительным выделением тепла:
Н2
+ F2 = 2 НF + 543 кДж
Реакция протекает обычно со
взрывом, который происходит даже
при сильном охлаждении газов и в
темноте. Практического значения
для получения НF этот прямой
синтез не имеет, но, в принципе, он
может быть использован для
создания реактивной тяги.
Промышленное получение
фтористого водорода основано на
взаимодействии СаF2 с
концентрированной Н2SO4 по реакции:
СаF2
+ Н2SO4 = СаSO4 +2 НF
Процесс проводят в стальных печах
при 120-300 °С. Части установки,
служащие для поглощения НF,
делаются из свинца.
В
качестве реактивного топлива
смесь фтора с водородом способна
давать удельный импульс 410 сек.
Бесцветное пламя, возникающее при
взаимодействии этих газов, может
иметь температуру до 4500 °С. В
лабораторных условиях для
получения чистого фтористого
водорода применяются обычно
небольшие установки
изготовленные целиком из платины
(или меди). Исходным веществом
служит тщательно высушенный
бифторид калия (КF·НF), при
нагревании разлагающийcя c
отщеплением НF. Полученный
продукт часто содержит примесь
механически увлеченного
бифторида. Для очистки его
подвергают перегонке при 35-40 °С.
Лечение отравлений:
Свежий воздух, тепловлажные содовые ингаляции; внутрь кодеин, дионин (по 0,015 г), препараты кальция, димедрол; горчичники, банки на грудь, отхаркивающие, теплое молоко с боржомом или содой. Успокаивающие средства. В более тяжелых случаях внутривенно хлористый кальций (10 мл 10% раствора). Сердечные средства. Полный покой. Немедленная госпитализация.
При ожогах концентрироанной фтороводородной кислотой — погружение обожженных мест в холодную воду на длительное время (до 12 ч при сильных ожогах). При контакте с раствором кислоты, даже если нет ощущения боли — обильное обмывание водой не менее чем в течение 10 мин, затем обработка обожженной поверхности марлей, смоченной в 10% растворе аммиака, и снова смывание водой. Более эффективно погружение на полчаса (или наложение компрессов, которые меняют через 2 мин в течение получаса) в сильно охлажденный раствор MgSO4 или 70% этиловый спирт. Затем наложить магнезиальную мазь (1 ч. MgO, 2 ч. медицинского вазелина или глицерина). Возможно раньше начать лечение: инъекция стерильного 10% раствора глюконата кальция или 20% раствора MgSO4 в струп и под него (при распространенных или глубоких ожогах 10-50 мл), затем снова магнезиальная мазь (сменять ее утром и вечером в течение 5- 6 дней), после этого такое же лечение, как при термических ожогах. Для предупреждения образования келоидов и обезображивающих рубцов рекомендуют синтомициновую эмульсию, мазь на рыбьем жире, пасты и мази с глюкокортикоидами.
При поражении глаз промывать их в течение получаса водой, затем ввести 2-3 капли 0,5% раствора дикаина. Нельзя применять масла или мази на жировой основе.
Индивидуальная защита. Фильтрующий противогаз марки В, при наличии тумана кислоты — с фильтром. Хорошо поглощает фтороводород ионитовое волокно (Маракантова). Резиновые перчатки, фартуки, сапоги. Для работы в цехах электролиза алюминия рекомендуется металлизированная спецодежда (Готлиб; Paterson). Защитные очки из оргстекла. Борьба с выделением фтороводорода в воздух рабочих помещений; герметизация аппаратуры, коммуникаций; использование особо стойких к коррозии материалов.
Фторсодержащие пластмассы
Наиболее востребованным из них является тефлон (фторопласт – 4). Он был открыт совершенно случайно. Химик-органик Рой Планкетт, занимавшийся синтезом фреонов, обнаружил в баллонах с газообразным четерыххлористым этиленом, хранящимся при аномально низкой температуре, не газ, а белый порошок, жирный на ощупь. Оказалось, что при высоком давлении и низкой температуре тетрафторэтилен полимеризовался.
Это реакция привела к образованию новой пластической массы. Впоследствии её назвали тефлоном. Он обладает исключительной тепло- и морозоустойчивостью. Тефлоновые покрытия с успехом применяют в пищевой, химической промышленности, при производстве посуды с антипригарными свойствами. Даже при 70 оС изделия из фторопласта – 4 не теряют свои свойства. Исключительной является высокая химическая инертность тефлона. Он не разрушается при контакте с агрессивными веществами – щелочами и кислотами
Это очень важно для оборудования, используемого в технологических процессах получения нитратной и сульфатной кислот, гидроксида аммония, едкого натра. Фторопласты могут содержать дополнительные компоненты – модификаторы, такие как стекловолокно или металлы, вследствие чего они меняют свои свойства, например, повышают термостойкость и износоустойчивость
Получение
Среднее содержание гафния в земной коре — около 4 г/т. Ввиду отсутствия у гафния собственных минералов и постоянного сопутствия его цирконию, его получают путём переработки циркониевых руд, где он содержится в количестве 2,5 % от веса циркония (циркон содержит 4 % HfO2, бадделеит — 4—6 % HfO2). В мире в год в среднем добывается около 70 тонн гафния, и объёмы его добычи пропорциональны объёмам добычи циркония
Интересна особенность скандиевого минерала — тортвейтита: в нём содержится гафния в процентном отношении гораздо больше, чем циркония, и это обстоятельство очень важно при переработке тортвейтита на скандий и концентрировании гафния из него.
Мировые ресурсы гафния
Цены на гафний 99 % в 2007 году в среднем составляли $780 за килограмм (по материалам infogeo.ru)
Мировые ресурсы гафния в пересчёте на двуокись гафния несколько превышают 1 миллион тонн. Структура распределения этих ресурсов выглядит приблизительно следующим образом:
- Австралия — более 630 тысяч тонн,
- ЮАР — почти 287 тысяч тонн,
- США — чуть более 105 тысяч тонн,
- Индия — около 70 тысяч тонн,
- Бразилия — 9,88 тысяч тонн.
Подавляющая часть сырьевой базы гафния в зарубежных странах представлена цирконом прибрежных морских россыпей.
Запасы гафния в России и СНГ, по оценкам независимых специалистов[Каких?], весьма велики[Насколько?] и в этом отношении при развитии гафниевой промышленности Россия способна стать безусловным лидером на мировом рынке гафния. Стоит также в связи с этим упомянуть весьма значительные ресурсы гафния на Украине. Основные гафнийсодержащие минералы в России и СНГ представлены лопаритом, цирконом, бадделеитом, редкометалльными щелочными гранитами.
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия путём электролиза;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами.
Ракетная техника
Основная статья: Соединения фтора в ракетной технике
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих видов ракетного топлива. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Основная статья: Соединения фтора в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и сильно ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать , в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация внешнего электронного уровня атома фтора
Электронная конфигурация атома фтора: 1s22s22p5.
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы
Применение метода МО для молекулы F2
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α-фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм, b = 0,32701(7) нм, c = 0,72651(17) нм, β = 102,088(18)°, Z = 4, d = 1,98 г/см3 с объёмом элементарной ячейки 0,12726(5) нм3 (при 10 К);
- β-фтор, прозрачный, менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K, кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm3n, параметры ячейки a = 0,65314(15) нм, Z = 8, d = 1,81 г/см3 с объёмом элементарной ячейки 0,27862(11) нм3 (при 48 К), решётка изотипична γ-фазе O2 и δ-фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β-фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см3, и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см3.
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм.
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Основная статья: Изотопы фтора
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31 и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Фтороводород
Фтороводород выше 19 5 С представляет собой бесцветный газ с резким раздражающим дыхательные пути действием, а ниже указанной температуры кипения — легкоподвижную бесцветную жидкость. HF характеризуется высоким значением электрического момента диполя ( 0 64 — Ю 29 Кл — м), превосходящим электрический момент диполя воды, сернистого газа и аммиака. Жидкий фторид водорода имеет большое значение диэлектрической постоянной, равное 83 6 при 0 С.
Фтороводород раздражает верхние дыхательные пути.
Фтороводород, присоединяясь к алкену, вызывает одновременно его полимеризацию.
Фтороводород, используемый для электрохимического фторирования органических соединений , является перспективным растворителем для электрохимических исследований. Он имеет высокую диэлектрическую постоянную ( 80 при 0 С), менее вязок, чем вода, прозрачен при ультрафиолетовом облучении в диапазоне до 165 нм и трудно окисляется. Это сильно протонирующий растворитель, который в отличие от серной кислоты не является окислителем. Он растворяет фториды многих металлов, образуя высокопроводящие растворы, кроме того в нем растворимы и многие органические соедш.
Фтороводород — бесцветный легко сжижаемый ( при 19 5) газ с резким запахом. Он поражает дыхательные пути, во влажном воздухе дымит. Водный раствор его называют фтороводородной или ( в технике) плавиковой кислотой. Эта слабая кислота диссоциирует с образованием анионов F -, HF. Пары ее очень ядовиты, вызывают ожоги кожи.
|
Средняя молекулярная масса и давление насыщенного пара фтороводорода. |
Фтороводород хорошо растворим в воде, его водные растворы HF ( aq) называют фтороводородной ( плавиковой) кислотой.
Фтороводород ядовит, поэтому опыт проводить под тягой.
Фтороводород, выделившийся при пирогидролизе Mg. Фторид-ион определяют спектрофотометри-чески по ослаблению окраски комплекса тория ( IV) сарсеназо.
Фтороводород значительно лучше растворяет изобутан, чем серная кислота, поэтому соотношение изобутан: алкен в зоне реакции ( в пленке кислоты, в которой идет реакция) значительно выше. Вследствие этого алкилирование протекает практически без побочных реакций и выход основных продуктов выше, чем при катализе серной кислотой. Заданную концентрацию фтороводорода поддерживают за счет отбора части катализатора на регенерацию. Фтороводород легко отделяется от воды перегонкой. Расход HF составляет примерно 0 7 кг на 1 т алкилата.
Фтороводород разрушает стекло ( образуются S1F4 и H2 ); при работе с HF используют аппаратуру из полимерных материалов, меди или свинца.
Фтороводород вместе с парами воды отводят в медный сосуд, охлаждаемый до — 10 С, где и конденсируется 70 — 75 % HF, содержащей значительное число примесей. Для получения чистой фто-роводородной кислоты технический продукт подвергают дистилляции во фторопластовой аппаратуре.
Фтороводород — это газ, который в — воде растворяется неограниченно.
Фтороводород в жидком и газообразном состояниях значительно ассоциирован вследствие образования сильных водородных связей ( см. разд.
|
Строение фторидов элементов третьего периода. |
Физические свойства
Гафний
Аномальный пик на экспериментальной кривой теплоёмкости гафния (1) и её разложение на дебаевскую составляющую (2) и аномальный остаток (3) — разность (1)-(2), слагающийся из больцмановских (4, 5) компонент
Гафний — блестящий серебристо-белый металл, твёрдый и тугоплавкий. В мелкодисперсном состоянии имеет тёмно-серый, почти чёрный цвет; матовый. Плотность при нормальных условиях — 13,31 г/см3. Температура плавления составляет 2506 K (2233 °C), кипит при 4876 K (4603 °C).
Гафний обладает высоким сечением захвата тепловых нейтронов — (115 барн у естественной смеси изотопов), тогда как у его химического аналога, циркония, сечение захвата на 3 порядка меньше, около 0,2 барн. В связи с этим цирконий, используемый для создания реакторных ТВЭЛов, должен быть тщательно очищен от гафния.
Температурная зависимость теплоёмкости гафния (аналогично теплоёмкости германия — Ge) имеет аномальный вид — на кривой теплоёмкости в диапазоне температур 60—80 К наблюдается пик, который не может быть объяснён никакой теорией, предполагающей гуковский закон сил, так как никакая суперпозиция эйнштейновских функций не даёт кривой с максимумом. В данном случае аномальный вид кривой теплоёмкости определяется суперпозицией колебательной (дебаевской) и диффузионной (больцмановской) компонент поглощения тепла кристаллической решеткой.
Изотопы гафния
Основная статья: Изотопы гафния
Известно более 30 изотопов гафния с массовыми числами от 153 до 188 (количество протонов 72, нейтронов от 81 до 116), и 26 ядерных изомеров. 5 изотопов стабильны и встречаются в природе (176Hf, 177Hf, 178Hf, 179Hf, 180Hf). Благодаря огромному периоду полураспада (период полураспада 2×1015 лет) в природе встречается один нестабильный изотоп, 174Hf.
Известен изомер гафния 178m2Hf
Он привлек внимание общественности в связи с исследованиями агентства оборонных исследований DARPA по принудительному распаду изомера с выделением значительных энергий. Начали высказываться гипотезы о возможности построения гафниевой бомбы (англ.)русск.
Тем не менее в научной среде ставится под сомнение как возможность управляемого взрывного распада 178m2Hf так и возможность получения изомера в количествах, необходимых для создания оружия.
Техническая плавиковая кислота
Техническая плавиковая кислота обычно содержит ряд примесей — Fe, Rb, As, кремнефтористоводородную кислоту Н2SiF6, SO2 и др.
Для грубой очистки её перегоняют в аппаратах из платины или свинца, отбрасывая первые порции дистиллята.
Для получения более чистой кислоты техническую кислоту переводят в гидрофторид калия, затем разлагают его нагреванием, растворяя фтористый водород в дистиллированной воде.
Крепкая плавиковая кислота (более 60 % HF) может сохраняться и транспортироваться в стальных ёмкостях, но разъедает стекло. Для хранения плавиковой кислоты и работы с ней в лабораторных условиях требуются сосуды из тефлона, полиэтилена и других пластмасс.
Свойства
Физические свойства
- Критическая температура фтористого водорода 188 °C, критическое давление 64 атм.
- Теплота испарения жидкого HF в точке кипения составляет лишь 7,5 кДж/моль (примерно в 6 раз меньше, чем у воды при 20 °C). Это обусловлено тем, что само по себе испарение мало меняет характер ассоциации фтористого водорода (димерная форма, характерная для жидкости, сохраняется и в парах — в отличие от фазового перехода воды).
- Диэлектрическая проницаемость жидкого фтористого водорода (84 при 0 °C) очень близка к значению д.п. для воды.
Химические свойства
Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с оксидами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:
-
- MgO+2HF→MgF2+H2O{\displaystyle {\mathsf {MgO+2HF\rightarrow MgF_{2}+H_{2}O}}}
Жидкий HF — сильный ионизирующий растворитель. Все электролиты, растворённые в нём, за исключением хлорной кислоты HClO4, являются основаниями:
-
- HCl+2HF⇄H2Cl++HF2−{\displaystyle {\mathsf {HCl+2HF\rightleftarrows H_{2}Cl^{+}+HF_{2}^{-}}}}
- В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5:
- BF3+2HF→H2F++BF4−{\displaystyle {\mathsf {BF_{3}+2HF\rightarrow H_{2}F^{+}+^{-}}}}
-
Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III):
- 3NaF+AlF3→3Na++AlF63−{\displaystyle {\mathsf {3NaF+AlF_{3}\rightarrow 3Na^{+}+^{3-}}}}
- (AlF3 — как кислота)
- AlF3+3BF3→Al3++3BF4−{\displaystyle {\mathsf {AlF_{3}+3BF_{3}\rightarrow Al^{3+}+3^{-}}}}
- (AlF3 — как основание)
Фтороводород в газообразном состоянии и в виде водного раствора реагирует с диоксидом кремния:
- При условии, если фтороводород в газообразном состоянии:
- 4HF+SiO2→SiF4+2H2O{\displaystyle {\mathsf {4HF+SiO_{2}\rightarrow SiF_{4}+2H_{2}O}}}
- При условии, если фтороводород в виде водного раствора:
- 6HF+SiO2→H2SiF6+2H2O{\displaystyle {\mathsf {6HF+SiO_{2}\rightarrow H_{2}+2H_{2}O}}}
Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF:
-
-
2HF+H2O⇄HF2−+H3O+{\displaystyle {\mathsf {2HF+H_{2}O\rightleftarrows HF_{2}^{-}+H_{3}O^{+}}}}
- Kd= 7,2·10−4
-
HF+F−⇄HF2−{\displaystyle {\mathsf {HF+F^{-}\rightleftarrows HF_{2}^{-}}}}
- Kd= 5,1
-
2HF+H2O⇄HF2−+H3O+{\displaystyle {\mathsf {2HF+H_{2}O\rightleftarrows HF_{2}^{-}+H_{3}O^{+}}}}
- Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Ag(I), Sn(II), Ni(II) и Mn(II). Все соли плавиковой кислоты ядовиты.
Строение молекулы
Молекула фотороводорода сильно полярна, μ = 0, 64·10-29 Кл·м. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FН приблизительно составляет 42 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии, фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствии высокой прочности связи, термический распад фотороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама, самого тугоплавкого из металлов, для сравнения, у воды термический распад становится заметным при температуры выше 2000 °C
Источник
- Ахметов Н.С. «Общая и неорганическая химия» М.:Высшая школа, 2001
- Карапетьянц М.Х. Дракин С.И. Общая и неорганическая химия. М.: Химия 1994
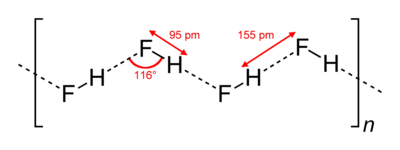
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные
цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе









