Составьте уравнение химической реакции, укажите ее тип: фосфор + хлор → хлорид фосфора (v)
Содержание:
- Качественная реакция на ион РО43-
- Получение и применение фосфора
- Галогены
- Потенциальные применения трихлорида и оксихлорида фосфора в фармацевтическом синтезе
- Химические свойства
- Химические свойства
- PCl3 и POCl3 в качестве субстратов в синтезе лекарств
- Гидролиз бинарных соединений действием растворов кислот и щелочей
- P2
- Химические свойства фосфора
- Аллотропные модификации фосфора
- Углерод
- Химические свойства
Качественная реакция на ион РО43-
— образование желтого осадка ортофосфата серебра(I).
Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций:
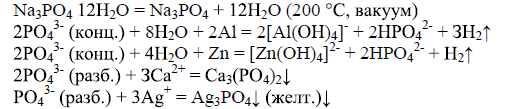
Получение: полная нейтрализация Н3Р04 гидроксидом натрия или по реакции:
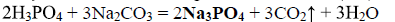
Гидроортофосфат натрия Na2HPO4. Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3Р04 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион НРО42-— образование желтого осадка ортофосфата серебра (I).
Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей.
Уравнения важнейших реакций:

Получение: неполная нейтрализация Н3Р04 гидроксидом натрия в разбавленном растворе:
2NaOH + Н3РО4 = Na2HPO4 + 2H2O
Получение и применение фосфора
Промышленным способом фосфор получают путем его восстановления коксом из фосфоритов (фторапататиов), в состав которых входит фосфат кальция, прокаливая в электропечах при температуре 1600°C с добавлением кварцевого песка:
Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO.
На первом этапе реакции под действием высокой температуры оксид кремния (IV) вытесняет оксид фосфора (V) из фосфата:
Ca3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5.
Затем оксид фосфора (V) восстанавливается углём до свободного фосфора:
P2O5+5C = 2P+5CO.
Применение фосфора:
- производство удобрений;
- ядохимикатов;
- спичек;
- моющих средств;
- красок;
- полупроводников.
Галогены
В VIIА группе находятся фтор, хлор, бром, йод и астат. Эти элементы называют также галогенами (в переводе — рождающие соли).
На внешнем энергетическом уровне всех этих элементов находятся 7 электронов (конфигурации ns2np5), наиболее характерные степени окисления –1, +1, +5 и +7 (кроме фтора).
Атомы всех галогенов образуют простые вещества состава Hal2.
Галогены являются типичными неметаллами. При переходе от фтора к астату происходит увеличение радиуса атома, неметаллические свойства падают, происходит уменьшение окислительных и увеличение восстановительных свойств.
Физические свойства галогенов приведены в таблице 8.
В химическом отношении галогены весьма активны. Их реакционная способность убывает с увеличением порядкового номера. Некоторые характерные для них реакции приведены ниже на примере хлора:
Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI.
Галогенводородные кислоты (за исключением HF) способны реагировать с такими сильными окислителями, как KMnO4, MnO2, K2Cr2O7, CrO3 и другими, с образованием галогенов:
Галогены образуют ряд оксидов, например, для хлора известны кислотные оксиды состава Cl2O, ClO2, ClO3, Cl2O7. Все эти соединения получают косвенными методами. Они являются сильными окислителями и взрывоопасными веществами.
Наиболее устойчивым из оксидов хлора является Cl2O7. Оксиды хлора легко реагируют с водой, образуя кислородсодержащие кислоты: хлорноватистую HClO, хлористую HClO2, хлорноватую HClO3 и хлорную HClO4, например:
В промышленности бром получают при вытеснении хлором из бромидов, а в лабораторной практике — окислением бромидов:
Простое вещество бром является сильным окислителем, легко вступает в реакции со многими простыми веществами, образуя бромиды; вытесняет йод из йодидов.
Простое вещество йод, I2, представляет собой чёрные с металлическим блеском кристаллы, которые возгоняются, т. е. переходят в пар, минуя жидкое состояние. Йод мало растворим в воде, но довольно хорошо растворяется в некоторых органических растворителях (спирт, бензол и т. д.).
Йод является довольно сильным окислителем, способным к окислению ряда металлов и некоторых неметаллов.
Потенциальные применения трихлорида и оксихлорида фосфора в фармацевтическом синтезе
Существует огромное количество научных исследований и патентов, указывающих на возможные применения PCl3 и POCl3 в области фармакологии. Эти публикации указывают на большой потенциал описываемых веществ, а их постоянно увеличивающаяся доля в секторе фармацевтических исследований может привести к расширению круга потенциальных применений в области фармацевтики.
Согласно упомянутым выше научным исследованиям, PCl3 может использоваться в качестве исходного вещества в сложном процессе синтеза препарата под названием Тенофовир. Это органическое соединение из группы фосфонатов, используемое для лечения гепатита типа В, а также для предотвращения симптомов вируса иммунодефицита 1 типа (ВИЧ 1), вызывающего СПИД. В свою очередь, POCl3 может найти потенциальное применение в секторе синтеза витаминов, поскольку он используется в одном из путей синтеза производных витамина B6.
Кроме того, оксихлорид фосфора может служить в качестве реагента в реакции фосфорилирования, то есть присоединения фосфатного остатка к нуклеофильному атому любого химического соединения. Во время реакции с нуклеозидами могут образовываться нуклеотиды, например производные гуанозина, такие как GMP (гуанозин-5′-монофосфат), который является одним из мономеров РНК, а его соли: динатрий (E627), дикалий (E628) и кальций (E629) являются добавками, усиливающими вкус, использующимися в пищевой промышленности.
Другим применением POCl3 является возможность использования его в реакции с N-фенилантраниловой кислотой для получения 9-хлоракридина. В результате дальнейших реакций он создает производные, которые рассматриваются как потенциальные лекарства со свойствами, останавливающими образование раковых опухолей в организме человека. Оксихлорид фосфора также может быть использован для производства абиратерона, активного вещества, используемого для лечения рака предстательной железы.
Химические свойства
Дымит на воздухе вследствие разложения водяными парами с образованием фосфорной кислоты и хлороводорода:
-
- POCl3+3H2O → H3PO4+3HCl{\displaystyle {\mathsf {POCl_{3}+3H_{2}O\ {\xrightarrow {}}\ H_{3}PO_{4}+3HCl}}}
Реагирует с щелочами:
-
- POCl3+6NaOH → Na3PO4+3NaCl+3H2O{\displaystyle {\mathsf {POCl_{3}+6NaOH\ {\xrightarrow {}}\ Na_{3}PO_{4}+3NaCl+3H_{2}O}}}
Используется для получения других оксигалогенидов фосфора:
-
- POCl3+3HF →65oC,SbCl5 POF3+3HCl{\displaystyle {\mathsf {POCl_{3}+3HF\ {\xrightarrow {65^{o}C,SbCl_{5}}}\ POF_{3}+3HCl}}}
- POCl3+3LiI →CS2 POI3+3LiCl{\displaystyle {\mathsf {POCl_{3}+3LiI\ {\xrightarrow {CS_{2}}}\ POI_{3}+3LiCl}}}
Химические свойства
Фосфор в PCl3 находится в степени окисления +3, а хлор — в степени −1. Многие из свойств соединения обусловлены именно этими обстоятельствами. В присутствии воды — дымит и разлагается.
PCl3 — базовый продукт для других производных фосфора, получаемых из него при окислении до пентахлорида (PCl5), тиофосфорилхлорида (PSCl3) или оксихлорида (POCl3).
Если пропустить электрический разряд через смесь пара PCl3 и газообразного водорода, образуется редкий сложный хлорид фосфора с формулой P2Cl4.
Известно большое число сходных реакций замещения, в том числе и с органическими веществами — спиртами и фенолами:
-
- 3C6H5OH+PCl3→(C6H5O)3P+3HCl{\displaystyle {\mathsf {3C_{6}H_{5}OH+PCl_{3}\rightarrow (C_{6}H_{5}O)_{3}P+3HCl}}}
Спирты реагируют сходным образом:
-
- PCl3+3C2H5OH+3R3N→(C2H5O)3P+3R3NHCl{\displaystyle {\mathsf {PCl_{3}+3C_{2}H_{5}OH+3R_{3}N\rightarrow (C_{2}H_{5}O)_{3}P+3Cl}}}
-
- PCl3+3C2H5OH→3C2H5Cl+H3PO3{\displaystyle {\mathsf {PCl_{3}+3C_{2}H_{5}OH\rightarrow 3C_{2}H_{5}Cl+H_{3}PO_{3}}}}
Наличие неподелённой электронной пары у атомов фосфора обуславливает способность трихлорида проявлять донорные свойства, образуя электронейтральные комплексы, например, [Ni(PCl3)4]
По химической природе трихлорид фосфора является хлорангидридом фосфористой кислоты. Гидролиз её приводит к образованию двух кислот, а взаимодействие со щелочами — двух солей:
-
- PCl3+3H2O→H3PO3+3HCl{\displaystyle {\mathsf {PCl_{3}+3H_{2}O\rightarrow H_{3}PO_{3}+3HCl}}}
-
- PCl3+5NaOH→Na2HPO3+3NaCl+2H2O{\displaystyle {\mathsf {PCl_{3}+5NaOH\rightarrow Na_{2}HPO_{3}+3NaCl+2H_{2}O}}}
PCl3 и POCl3 в качестве субстратов в синтезе лекарств
Первым примером использования PCl3 является его использование в качестве реагента — вещества, используемого для синтеза лекарств на основе производных сульфонамида. Среди представителей этой группы препаратов можно выделить:
- хлорталидон – диуретик (мочегонное средство), применяемый при таких заболеваниях, как гипертония, несахарный диабет и печеночная и почечная недостаточность,
- сульфадиазин — используется для лечения ожогов. Это вещество также применяется для антибактериальной профилактики по всему телу, используя процесс остановки образования фолиевой кислоты в бактериальных клетках. Кроме того, сочетание сульфадиазина и пириметамина используется для противодействия токсоплазмозу, то есть паразитарной болезни людей и животных, вызванной протозойной инфекцией.
Как PCl3, так и POCl3 используются в качестве субстратов в процессе синтеза производных аминометил бис-бис-фосфоновая кислота, известная как золедроновая кислота, которая обладает способностью накапливаться в костях. Ее действие заключается в стимуляции остеобластов образовывать костную ткань и ингибировать кальцификацию костей. Применяется в основном для лечения переломов и в костной хирургии для предотвращения костных осложненияй.
Гидролиз бинарных соединений действием растворов кислот и щелочей
Помимо обычного гидролиза водой существует также вариант гидролиза, при котором бинарное соединение обрабатывают водным раствором щелочи или кислоты.
Как в таком случае записать уравнение гидролиза?
Для того, чтобы записать уравнение гидролиза бинарного соединения водным раствором щелочи или кислоты, нужно:
1) в первую очередь, представить, какие продукты образовались бы при обычном гидролизе водой.
Например, мы хотим записать уравнение щелочного гидролиза соединения PCl5 действием водного раствора KOH.
Тогда, согласно этому пункту, мы должны вспомнить какие продукты образуются при обычном гидролизе. В нашем случае это HCl и H3PO4
2) посмотреть на отношение этих продуктов к средообразователю (кислоте или щелочи) – реагируют они или нет. Если продукты обычного гидролиза реагируют со средообразователем, то запомнить продукты этого взаимодействия.
Возвращаясь к нашему случаю с PCl5, мы должны посмотреть на то, как относятся к щелочи продукты обычного гидролиза, т.е. HCl и H3PO4. Оба данных соединения в водном растворе являются кислотами, в связи с чем существовать в щелочной среде не могут. В частности, с гидроксидом калия они прореагируют, образуя соответственно соли KCl и K3PO4
3) в конечном уравнении в качестве продуктов записать то, что получается при взаимодействии со средообразователем. Воду при этом мы пока не пишем, вывод о том, писать ее или нет, делаем после попытки уравнивания реакции без нее.
Таким образом, следуя этому принципу, запишем:
PCl5 + KOH = KCl + K3PO4
Уже до начала расстановки коэффициентов очевидно, что есть необходимость в записи в качестве одного из продуктов реакции воды, поскольку в левой части присутствует водород, а в правой его нет.
Таким образом, суммарная схема реакции будет иметь вид:
PCl5 + KOH = KCl + K3PO4 + H2O
А само уравнение после расстановки коэффициентов будет выглядеть так:
PCl5 + 8KOH = 5KCl + K3PO4 + 4H2O
Следует отметить, что щелочной гидролиз ионных соединений чаще всего не отличается от обычного гидролиза действием воды, поскольку чаще всего ни один продукт обычного гидролиза с щелочью не взаимодействует.
Аналогично, можно сказать, что кислотный гидролиз ковалентных бинарных соединений не будет отличаться от водного.
В связи с этим имеет смысл более детально рассмотреть кислотный гидролиз ионных бинарных соединений и щелочной гидролиз ковалентных бинарных соединений.
Кислотный гидролиз ионных бинарных соединений
Со всеми перечисленными ионными бинарными соединениями, участвовавшими в реакциях обычного гидролиза водой, можно записать соответствующие уравнения их кислотного гидролиза. Возьмем в качестве примера водный раствор соляной кислоты:
1) Ca3P2 + 6HCl = 3CaCl2 + 2PH3
2) Mg2Si + 4HCl(р-р) = 2MgCl2 + SiH4
3) Al4C3 + 12HCl(р-р) = 4AlCl3 + 3CH4
4) Al2S3 + 6HCl = 2AlCl3 + 3H2S
5) Ca3N2 + 8HCl(р-р) = 3CaCl2 + 2NH4Cl
Обратите внимание, что вместо водородного соединения в случае нитридов металлов образуется продукт его взаимодействия с соляной кислотой (NH3 + HCl = NH4Cl). Следует отметить, что нитриды металлов – единственный случай, когда при кислотном гидролизе ионного бинарного соединения не выделяется газообразное водородное соединение
Связано это с тем, что по сравнению с другими водородными соединениями неметаллов, только у аммиака основные свойства выражены в значительной степени.
6) CaH2 + 2HCl(р-р) = CaCl2 + 2H2
Как можно заметить, кислотный гидролиз гидридов металлов также относится к окислительно-восстановительным реакциям. В результате этой реакции образуется простое вещество водород. Связано это с тем, что водород с кислотами не реагирует.
Щелочной гидролиз ковалентных бинарных соединений
Щелочному гидролизу среди ковалентных соединений подвержены все те же бинарные соединения, что и обычному гидролизу водой, то есть галогениды фосфора и кремния:
PBr5 + 8NaOH = Na3PO4 + 5NaBr + 4H2O
SiCl4 + 6KOH = K2SiO3 + 4KCl + 3H2O
Щелочной гидролиз галогенидов фосфора III в ЕГЭ не встретится из-за специфических свойства фосфористой кислоты.
Тем не менее, для тех, кто хочет, ниже предоставляю пример такого рода уравнений с пояснением:
PCl3 + 5KOH = K2HPO3 + 3KCl + 2H2O
Поскольку фосфористая кислота является двухосновной, то несмотря на наличие трех атомов водорода, при ее реакции с щелочью на атомы металла способны заместиться только два атома водорода.
P2
Два атома фосфора объединяются в молекулу P2 при температуре порядка 1000°C.
При более низких температурах фосфор существует в четырехатомных молекулах P4, а также в более устойчивых полимерных молекулах P∞.
Аллотропные модификации фосфора:
- Белый фосфор — чрезвычайно ядовитое (летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г) воскоподобное вещество с запахом чеснока, без цвета, люминисцирующее в темноте (процесс медленного окисления в P4O6); высокая реакционная способность белого фосфора объясняется некрепкими связями Р-Р (у белого фосфора молекулярная кристаллическая решетка с формулой P4, в узлах которой расположены атомы фосфора), которые достаточно легко разрываются, в результате чего белый фосфор при нагревании или в процессе длительного хранения переходит в более устойчивые полимерные модификации: красный и черный фосфор. По этим причинам белый фосфор хранят без доступа воздуха под слоем очищенной воды или в специальных инертных средах.
- Желтый фосфор — огнеопасное, сильно ядовитое вещество, в воде не растворяется, легко окисляется на воздухе и самовозгорается, при этом горит ярко-зеленым ослепительным пламенем с выделением густого белого дыма.
- Красный фосфор — полимерное, нерастворимое в воде вещество со сложной структурой, обладающее наименее реакционной способностью. Красный фосфор широко применяется в промышленном производстве, т. к. не так сильной ядовит. Поскольку на открытом воздухе красный фосфор, впитывая влагу, постепенно окисляется с образованием гигроскопичного оксида («отсыревает»), образует вязкую фосфорную кислоту, поэтому, красный фосфор хранится в герметически закрытой таре. В случае отмокания красный фосфор очищают от остатков фосфорной кислоты путем промывания водой, затем высушивают и используют по назначению.
- Черный фосфор — жирное на ощупь графитоподобное вещество серо-черного цвета, обладающее полупроводниковыми свойствами — наиболее устойчивая модификация фосфора со средней реакционной способностью.
- Металлический фосфор получают из черного фосфора под высоким давлением. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства фосфора
Из всех аллотропных модификаций фосфора самой активной является белый фосфор (P4). Зачастую в уравнении химических реакций пишут просто P, а не P4. Поскольку, фосфор, как и азот, имеет много вариантов степеней окисления, то в одних реакциях он является окислителем, в других — восстановителем, в зависимости от веществ, с которыми он взаимодействует.
Окислительные свойства фосфор проявляет в реакциях с металлами, которые протекают при нагревании с образованием фосфидов: 3Mg + 2P = Mg3P2.
Фосфор является восстановителем в реакциях:
- с более электроотрицательными неметаллами (кислородом, серой, галогенами):
- соединения фосфора (III) образуются при недостатке окислителя 4P + 3O2 = 2P2O3
- соединения фосфора (V) — при избытке: кислорода (воздуха) 4P + 5O2 = 2P2O5
- с галогенами и серой фосфор образует галогениды и сульфид 3-х или 5-ти валентного фосфора, в зависимости от соотношения реагентов, которые берутся в недостатке или избытке:
- 2P+3Cl2(нед.) = 2PCl3 — хлорид фосфора (III)
- 2P+3S(нед.) = P2S3 — сульфид фосфора (III)
- 2P+5Cl2(изб.) = 2PCl5 — хлорид фосфора (V)
- 2P+5S(изб.) = P2S5 — сульфид фосфора (V)
- с концентрированной серной кислотой:2P+5H2SO4 = 2H3PO4+5SO2↑+2H2O
- с конецнтрированной азотной кислотой:P+5HNO3 = H3PO4+5NO2↑+H2O
- с разбавленной азотной кислотой:3P+5HNO3+2H2O = 3H3PO4+5NO↑
НАДО ЗАПОМНИТЬ: с другими кислотами, кроме указанных выше реакций, фосфор не реагирует.
Аллотропные модификации фосфора
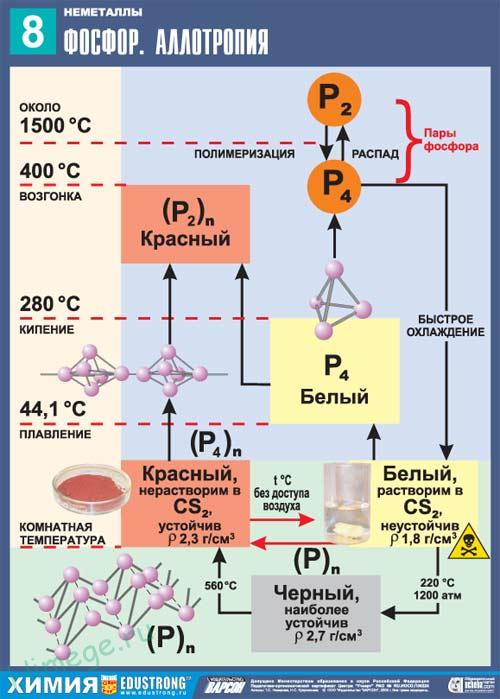
 Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные — это белый фосфор Р4 и красный фосфор Pn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные — это белый фосфор Р4 и красный фосфор Pn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Красный фосфор состоит из полимерных молекул Pn разной длины. Аморфный, при комнатной температуре медленно переходит в белый фосфор. При нагревании до 416 °С возгоняется (при охлаждении пара конденсируется белый фосфор). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. На воздухе загорается только при нагревании.
Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек. Не ядовит.
Белый фосфор состоит из молекул Р4. Мягкий как воск (режется ножом). Плавится и кипит без разложения (tпл 44,14 °С, tкип 287,3 °С, р 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), при большой массе возможно самовоспламенение. В особых условиях переводится в красный фосфор. Хорошо растворим в бензоле, эфирах, сероуглероде. Не реагирует с водой, хранится под слоем воды. Чрезвычайно химически активен. Проявляет окислительно-восстановительные свойства. Восстанавливает благородные металлы из растворов их солей.
Применяется в производстве Н3Р04 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
Углерод
Химический элемент углерод расположен во 2-м периоде, главной подгруппе IV группы периодической системы Д.И. Менделеева, его электронная формула 1s22s22p2, наиболее характерные степени окисления –4, +2, +4.
Для углерода известны стабильные аллотропные модификации (графит, алмаз, аллотропия строения), в виде которых он встречается в природе, а также полученные лабораторным путём карбин и фуллерены.
Алмаз — кристаллическое вещество с атомной координационной кубической решёткой. Каждый атом углерода в алмазе находится в состоянии sp3-гибридизации и образует равноценные прочные связи с четырьмя соседними атомами углерода. Это обуславливает исключительную твёрдость алмаза и отсутствие в обычных условиях электропроводности.
В графите атомы углерода находятся в состоянии sp2-гибридизации. Атомы углерода объединены в бесконечные слои из шестичленных колец, стабилизированные ω-связью, делокализованные в пределах всего слоя. Этим объясняется металлический блеск и электрическая проводимость графита. Углеродные слои объединены в кристаллическую решётку в основном за счёт межмолекулярных сил. Прочность химических связей в плоскости макромолекулы значительно больше, чем между слоями, поэтому графит довольно мягок, легко расслаивается и химически несколько активнее алмаза.
В состав древесного угля, сажи и кокса входят очень мелкие кристаллы графита с очень большой поверхностью, которые называют аморфным углеродом.
В карбине атом углерода находится в состоянии sp-гибридизации. Его кристаллическая решётка построена из прямолинейных цепочек двух видов:
Карбин представляет собой порошок чёрного цвета с плотностью 1,9—2,0 г/см3, является полупроводником.
Аллотропные модификации углерода могут переходить друг в друга при определённых условиях. Так, при нагревании без доступа воздуха при температуре 1750 °С алмаз переходит в графит.
В нормальных условиях углерод весьма инертен, однако при высоких температурах он вступает в реакции с различными веществами, причём самой реакционноспособной формой является аморфный углерод, менее активен графит, а самый инертный — алмаз.
Реакции, характерные для углерода:
Углерод устойчив к действию кислот и щелочей. Только горячие концентрированные азотная и серная кислоты могут окислить его до оксида углерода (IV):
Углерод восстанавливает многие металлы из их оксидов. При этом в зависимости от природы металла образуются либо чистые металлы (оксиды железа, кадмия, меди, свинца), либо соответствующие карбиды (оксиды кальция, ванадия, тантала), например:
Углерод образует два оксида: CO и CO2.
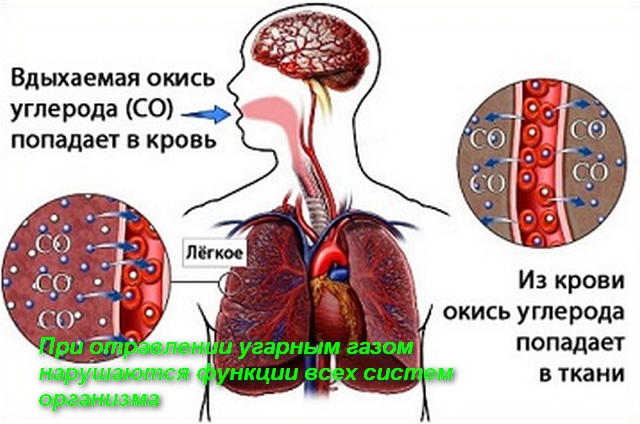
Оксид углерода (II) CO (угарный газ) представляет собой бесцветный газ без запаха, плохо растворимый в воде. Это соединение является сильным восстановителем. Он горит на воздухе с выделением большого количества теплоты, благодаря чему CO является хорошим газообразным топливом.
Оксид углерода (II) восстанавливает многие металлы из их оксидов:
Оксид углерода (II) является несолеобразующим оксидом, с водой и щелочами он не реагирует.
Оксид углерода (IV) CO2 (углекислый газ) представляет собой бесцветный, без запаха, негорючий газ, малорастворимый в воде. В технике его обычно получают термическим разложением CaCO3, а в лабораторной практике — действием на CaCO3 соляной кислоты:
Оксид углерода (IV) является кислотным оксидом. Его характерные химические свойства:
Оксиду углерода (IV) соответствует очень слабая двухосновная угольная кислота H2CO3, которая не существует в чистом виде. Она образует два ряда солей: средние — карбонаты, например карбонат кальция CaCO3, и кислые — гидрокарбонаты, например Ca(HCO3)2 — гидрокарбонат кальция.
Карбонаты переходят в гидрокарбонаты под действием избытка углекислого газа в водной среде:
Гидрокарбонат кальция превращается в карбонат под действием гидроксида кальция:
Гидрокарбонаты и карбонаты разлагаются при нагревании:
Химические свойства
Основные химические свойства фосфора и его соединений описаны в таблице.
|
Вещество |
Реакция |
Особенности |
Уравнение |
|
Фосфор |
С O2 |
При избытке O2 образует оксид фосфора (V) |
– 4P + 5O2 → 2P2O5; – 4P + 3O2 → 2P2O3 |
|
С металлом |
Является окислителем |
3Mg + 2P → Mg3P2 |
|
|
С галогенами и неметаллами |
Не реагирует с водородом |
2P + 3S → P2S3 |
|
|
С Н2О |
8Р + 12Н2О → 5РН3 + 3Н3РО2 |
||
|
С кислотами |
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
||
|
Со щелочами |
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 |
||
|
РН3 |
С O2 |
Воспламеняется на воздухе |
РН3 + 2O2 → H3PO4 |
|
С галогенами и неметаллами |
РН3 + 2I2 + 2H2O → H(PH2O2) + 4HI |
||
|
С кислотами |
Проявляет свойства восстановителя |
РН3 + 3H2SO4 → H2(PHO2) + 3SO2 + 3H2O |
|
|
H3PO4 |
С металлами |
С активными металлами |
|
|
С Н2О |
Подвергается диссоциации |
H3PO4 + H2O H3O+ + H2PO4– |
|
|
Со щелочами |
Образует кислые или щелочные фосфаты |
H3PO4 + 3NaOH → Na3PO4 + 3H2O |
|
|
С оксидами |
2H3PO4 + 3K2O → 2K3PO4 + 3H2O |
||
|
С солями |
|||
|
С аммиаком |
H3PO4 + 3NH3 → (NH4)3PO4 |
||
|
P2O3 |
С галогенами и неметаллами |
– 2P2O3 + 6Cl2 → 4PCl3O + O2; – 2P2O3 + 9S → P4S6 + 3SO2 |
|
|
С Н2О |
Медленно реагирует с холодной водой и быстро – с горячей |
P2O3 + 3H2O → 2H3PO3 |
|
|
Со щелочами |
P2O3 + 4NaOH → 2Na2HPO3 + H2O |
||
|
P2O5 |
С Н2О |
Реагирует с взрывом |
2P2O5 + 6H2O → 4H3PO4 |
|
С кислотами |
Реакция замещения |
4HNO3 + 2P2O5 → 4HPO3 + 2N2O5 |
|
|
Фосфиды |
С Н2О |
Образуют гидроксиды металлов и фосфин |
Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3 |
|
С кислотами |
Реакция замещения |
Ca3P2 + 6HCl → 3CaCl2 + 2PH3 |
При нагревании оксид фосфора распадается. Причём P2O3 образует красный фосфор, а P2O5 – оксид фосфора (III) и кислород.
Рис. 3. Красный фосфор.