Вулканические газы
Содержание:
- Попутный газ
- Что такое инертные газы?
- Нефтяной газ
- Основные свойства
- Месторождения природного газа
- Самый токсичный газ: VX
- Самый популярный отравляющий газ
- 2.2 Классификация согласно минимальным воспламеняющим токам (МВТ)
- Пути решения данной экологической проблемы
- Классификация по степени горючести
- Применение
- Активные
- Природный газ: состав
- Химические свойства
- Запасы природного газа
- Координационная химия
- Применение горючих газов
- Некоторые характеристики элементов VIIIА подгруппы (инертных газов).
- Сжиженный газ и его роль
- Общие сведения о природном газе. Обзор природного газа.
Попутный газ
Если природный газ добывается из буровых скважин, то попутный является побочным продуктом нефтедобычи. Содержание метана в таком газе несколько меньше, чем в традиционном природном. Однако при сгорании газообразного топлива выделяется сопоставимое тепло.
Побочный газ (попутный) вырабатывается также металлургическими комбинатами. На этих предприятиях горючее выделяется в печах. Это так называемые коксовый и доменный газы. Как правило, эти газы сжигаются на месте (подаются в печь или в котельную станцию). Аналогичный побочный продукт вырабатывается в глубоких шахтах, что часто приводит к катастрофам.

Что такое инертные газы?
Благородные газы, известные в химии благодаря своему уникальному свойству не смешиваться с другими веществами, также часто называют инертными. Как можно судить из названия, “благородство” инертных газов не позволяет им взаимодействовать с более простыми субстанциями и даже друг с другом. Такая избирательность благородных газов вызвана их атомным строением, которое проявляется в замкнутой внешней электронной оболочке, не позволяющей радону, гелию, ксенону, аргону, криптону и неону обмениваться своими электронами с атомами других газов.
Самым распространенным инертным газом в природе считают аргон, который занимает почетное третье место по содержанию в атмосфере Земли после азота и кислорода. У аргона нет вкуса, запаха и цвета, однако именно этот газ считается одним из самых распространенных во Вселенной. Так, наличие этого газа наблюдается даже в некоторых планетарных туманностях и в составе некоторых звезд.

При нагревании в газоразрядной трубке аргон приобретает розовый оттенок
Самым редким благородным газом в природе считают ксенон, который несмотря на свою редкость, содержится в атмосфере Земли наряду с аргоном. Ксенон обладает наркотическими свойствами и часто применяется в медицине в качестве анестезирующего средства. Кроме того, согласно данным Всемирного антидопингового агентства, ингаляции этого редкого газа имеют допинговый эффект, влияющий на физическое состояние применяющих его спортсменов. Заполнение ксеноном легких человека приводит к временному понижению тембра голоса, что является эффектом, обратным применению гелия.
При нагревании ксенон светится фиолетовым цветом
Четверо остальных благородных газов — Радон, Гелий, Неон и Криптон — также обладают своими уникальными свойствами. Все они не имеют какого-либо специфического вкуса, запаха или цвета, однако присутствуют в атмосфере Земли в небольших количествах и важны для нашего дыхания. Так, гелий считается одним из самых распространенных элементов в космосе, а его наличие в атмосфере Солнца, в составе других звезд Млечного Пути и некоторых метеоритов подтверждено научными данными.
Неон, светящийся при нагревании красноватым оттенком, получается из воздуха при его глубоком охлаждении. Из-за сравнительно небольшой концентрации этого инертного газа в атмосфере планеты, неон чаще всего получают в качестве побочного продукта при добыче аргона.
Радон — радиоактивный инертный газ, который может представлять опасность для человеческого здоровья. Газообразный радон способен светиться голубым или синим светом, постепенно облучая человека и даже приводя к онкологическим заболеваниям. Несмотря на это, в медицине часто применяются так называемые радоновые ванны, которые позволяют добиться положительного эффекта при лечении болезней центральной нервной системы.

Радоновое озеро в селе Лопухинка Ленинградской области
И наконец, последний благородный газ, который можно найти в природе — криптон. Это один из самых редких благородных газов во Вселенной. В отличии от остальных инертных газов, этот газ при определенных условиях может испускать резкий запах, схожий с запахом хлороформа. Воздействие криптона на человека и животных крайне мало изучено из-за невероятной редкости этого газа.
Нефтяной газ
Данный вид газа изначально растворен в нефти и представляет собой разрозненные химические элементы. Во время добычи и обработки, нефть подвергают различным воздействиям (крекинг, гидроочистка и т.д.), в результате чего из нее начинает выделяться газ. Этот процесс происходит непосредственно на нефтяных вышках, а классическим способом его удаления является сжигание. Те, кто хоть раз видел работающую нефтяную вышку-качалку, наверняка замечал горящий рядом огненный факел.
Сейчас все чаще нефтяной газ используют в производственных целях, например, закачивают в подземные пласты для увеличения внутреннего давления и упрощения подъема нефти из скважины.
Нефтяной газ хорошо горит, поэтому его можно поставлять на предприятия или смешивать с природным газом.
Основные свойства
Начнем с того, что известная фраза по поводу запаха газа в квартире или на улице не совсем правильна. У природного газа, который подается нам в квартиры для приготовления пищи или для подогрева воды, нет ни вкуса, ни запаха. То, что мы ощущаем, есть не что иное, как специальная добавка, необходимая для определения утечек газа. Это так называемый одорант, добавляют его на специально оборудованных станциях в следующих пропорциях: 16 мг на одну тысячу кубометров газа.
Основным компонентом природного газа, безусловно, является метан. Его содержание в газовой смеси составляет порядка 89-95%, остальные компоненты — это бутан, пропан, сероводород и так называемые примеси — пыль и негорючие компоненты, кислород и азот. Процент содержания метана зависит от типа месторождения.

Энергия природного газа, выделяемая при сгорании одного кубометра топлива, называется теплотой сгорания. Данная величина является одной из начальных во всех вопросах проектирования газовых объектов, и в разных странах за основу берутся различные значения. В России расчет ведется по низшей теплоте сгорания, в странах Запада, таких как Франция и Великобритания, — по высшей.
Говоря о взрывоопасности природного газа, стоит упомянуть о таких понятиях, как пределы взрываемости и опасная концентрация. Газ взрывается при концентрации его в помещении от 5 до 15 % от объема. Если концентрация ниже, газ не горит, если концентрация более 15%, то газовоздушная смесь горит при дополнительной подаче воздуха. Опасной концентрацией принято называть 1/5 от нижнего предела взрываемости, то есть 1%.
Месторождения природного газа
Глубокое разведочное бурение на нефть и газ в России, по данным Росстата
В осадочной оболочке земной коры сосредоточены огромные залежи природного газа. Согласно теории биогенного (органического) происхождения нефти, они образуются в результате разложения останков живых организмов. Считается, что природный газ образуется в осадочной оболочке при бо́льших температурах и давлениях, чем нефть. С этим согласуется тот факт, что месторождения газа часто расположены глубже, чем месторождения нефти.
Огромными запасами природного газа обладают Россия (Уренгойское месторождение), Иран, большинство стран Персидского залива, США, Канада. Из европейских стран стоит отметить Норвегию, Нидерланды. Среди бывших республик Советского Союза большими запасами газа владеют Туркмения, Азербайджан, Узбекистан, а также Казахстан (Карачаганакское месторождение).
Метан и некоторые другие углеводороды широко распространены в космосе. Метан — третий по распространённости газ во Вселенной, после водорода и гелия. В виде метанового льда он участвует в строении многих удалённых от солнца планет и астероидов, однако такие скопления, как правило, не относят к залежам природного газа, и они до сих пор не нашли практического применения. Значительное количество углеводородов присутствует в мантии Земли, однако они тоже не представляют интереса.
Газогидраты
В науке долгое время считалось, что скопления углеводородов с молекулярным весом более 60 пребывают в земной коре в жидком состоянии, а более лёгкие — в газообразном. Однако во второй половине XX века группа сотрудников Московского института нефти и газа А. А. Трофимук, Н. В. Черский, Ф. А. Требин, Ю. Ф. Макогон, В. Г. Васильев обнаружили свойство природного газа в определённых термодинамических условиях переходить в земной коре в твёрдое состояние и образовывать газогидратные залежи. Позже выяснилось, что запасы природного газа в этом состоянии огромны.
Газ переходит в твёрдое состояние в земной коре, соединяясь с пластовой водой при гидростатических давлениях до 250 атм и сравнительно низких температурах (до +22 °C). Газогидратные залежи обладают несравненно более высокой концентрацией газа в единице объёма пористой среды, чем в обычных газовых месторождениях, так как один объём воды при переходе её в гидратное состояние связывает до 220 объёмов газа. Зоны размещения газогидратных залежей сосредоточены главным образом в районах распространения многолетнемёрзлых пород, а также на небольшой глубине под океаническим дном.
Самый токсичный газ: VX
VX относится к фосфорорганическим соединениям и классифицируется как нервно-паралитический агент, поскольку влияет на передачу нервных импульсов. Он не имеет запаха и вкуса в чистом виде и выглядит как коричневатая маслянистая жидкость.
Разработанный в Великобритании в начале 1950-х, этот смертельный газ особенно эффективен, потому что он является постоянным агентом: как только он выпущен в атмосферу, он медленно испаряется. При обычных погодных условиях VX может сохраняться в течение нескольких дней на поверхности, в то время как в очень холодных условиях его действие может длиться месяцами. Пары VX тяжелее воздуха.
VX также является быстродействующим агентом. Симптомы могут появиться только через несколько секунд после воздействия. Они включают слюноотделение, сужение зрачков и стеснение в груди. Как и другие нервные агенты, VX воздействует на фермент (ацетилхолинэстеразу), который действует как «выключатель» организма для желез и мышц. Смерть вызывается удушьем или сердечной недостаточностью. Смертельная концентрация газа в зависимости от того, вдыхается он или подпадает на кожу, составляет 70-100 мкг/кг.

Самый популярный отравляющий газ
Горчичный газ (иприт), также известный как серая горчица, получил свое название от запаха гнилой горчицы или чеснока и лука. Он относится к группе блистерных агентов, которые воздействуют на глаза, дыхательные пути и кожу, сначала как раздражитель, а затем как яд для клеток организма. Когда кожа подвергается воздействию, она краснеет и горит в течение нескольких часов, прежде чем появляются большие волдыри, которые вызывают сильные рубцы и боль. Глаза будут опухать, слезиться, а через несколько часов после воздействия возможна слепота. При вдыхании или проглатывании у жертв этого смертельного газа появляются чихание, хрипота, кашель с кровью, боль в животе и рвота.
Однако воздействие горчичного газа не всегда смертельно. Когда он был впервые использован в Первой мировой войне, он убил только 5 % людей, подвергшихся воздействию. Из-за своих свойств он стал популярным химическим оружием, которое использовалось в обеих мировых войнах, во время гражданской войны в Йемене и ирано-иракской войне.

Наряду с ужасными физическими эффектами горчичный газ является химически стабильным и очень стойким. Его пары более чем в шесть раз тяжелее воздуха и остаются на земле в течение нескольких часов. Это сделало его особенно полезным для отравления траншей противника. Он остается токсичным в течение одного или двух дней при средних погодных условиях и от недель до месяцев в очень холодных условиях. Более того, стойкость может быть увеличена путем загущения агента: растворения его в нелетучих растворителях. Это создает значительные проблемы для защиты, дезактивации и лечения.
Вероятность его использования вынуждает войска противника носить полную защитную экипировку, тем самым снижая их эффективность. Но защитное снаряжение не всегда срабатывает. Например, противогазов часто недостаточно. Во время ирано-иракской войны горчичный газ просачивался через маски, когда бороды молодых иранцев, обязательные к ношению, нарушали герметичность масок. Горчичный газ также легко проникает через одежду, обувь или другие материалы.
2.2 Классификация согласно минимальным воспламеняющим токам (МВТ)
Для электрооборудования с
взрывозащитой вида «искробезопасная электрическая цепь» газы и пары
классифицируют согласно соотношению их минимальных воспламеняющих токов к
минимальному воспламеняющему току лабораторного метана.
Стандартный метод
определения соотношения МВТ должен основываться на использовании оборудования,
описанного в ГОСТ Р 51330.4. Если определения соотношения МВТ проводят на
другом оборудовании, их результаты можно принимать лишь условно (в качестве
предварительных).
Группы электрооборудования (категории
взрывоопасности газа, пара):
I — для
использования в подземных горных выработках (метан подземных выработок);
II — для применения в других
отраслях промышленности (газы и пары, кроме метана подземных выработок).
Установлены следующие
категории взрывоопасности газов и паров (подгруппы электрооборудования группы
II) в зависимости от соотношения МВТ:
IIA —
соотношение МВТ более 0,8;
IIB — соотношение МВТ от
0,45 до 0,8 включ.;
IIC — соотношение МВТ менее
0,45.
Пути решения данной экологической проблемы
Россия активно участвует во всемирных программах по борьбе с выбросами парниковых газов, оказывающих отепляющее влияние на климат. В рамках Киотского протокола и Рамочной конвенции ООН наша страна принимает комплекс мер, направленных на решение экологической проблемы.
Использование альтернативных источников энергии
Такие источники энергии позволяют полностью избежать вредных выбросов ПГ в атмосферу. Сейчас в странах Западного и Восточного полушария уже работают солнечные, ветряные, волновые, приливные, геотермальные электростанции, ГЭС. Применение биотоплива является «меньшим злом», чем использование традиционных источников энергии, но способствует не охране, а разрушению окружающей среды (вырубка лесов, сокращение площади сельскохозяйственных земель).
Современные технологии по удалению газов из атмосферы
Главную опасность представляет диоксид углерода, перешедший в 2013 г опасную отметку в 400 ppm. Научные институты и крупные корпорации разрабатывают новые методики по удалению газов из атмосферы. Какие из них окажутся жизнеспособными, покажет время, ведь себестоимость вывода из атмосферы 1 т CO2 обходится в 600 $.
- Двуокись углерода улавливается из воздуха модулем, содержащим химический раствор. Молекулы CO2 абсорбируются, проходят цикл регенерации. Из жидкости выделяется чистый диоксид углерода, который используют в промышленных целях.
- Профессор Ланкер из США разработал модель «искусственного дерева». Его листья поглощают оксид углерода в 1 тыс. раз эффективнее живого растения. Листья из пластика обработаны смолой, содержащей карбонат натрия, абсорбирующий CO2.
В горной промышленности научились собирать сопутствующей добыче метан, не давая CH4 попасть в атмосферу. Его откачивают через патрубки герметичной камеры во время отработки пластов породы.
Классификация по степени горючести
Все виды газов, в зависимости от поведенческих характеристик в процессах возгорания и горения, делятся на окислители, инертные и горючие.
- Окислители способствуют возгоранию и поддерживают горение, но сами не горят: воздух, кислород, фтор, хлор, окись и двуокись азота.
- Инертные не участвуют в горении, однако имеют свойство вытеснять кислород и влиять на снижение интенсивности процесса: гелий, неон, ксенон, азот, аргон, углекислый газ.
- Горючие загораются или взрываются, соединяясь с кислородом: метан, аммиак, водород, ацетилен, пропан, бутан, угарный газ, этан, этилен. Большинство из них характеризуется горением только в условиях определенного состава газовой смеси. Благодаря этому свойству, газ – вид топлива, на сегодняшний день самый распространенный. В этом качестве используются метан, пропан, бутан.

Применение

Благородные газы в вакуумных стеклянных колбах, через которые пропущен ток
Лёгкие инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Жидкий гелий, который кипит при 4,2 К (−268,95 °C), используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса. Жидкий неон, хотя его температура кипения (–246,03 °C) и не достигает таких низких значений как у жидкого гелия, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода.
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как азотное отравление.
Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к [неавторитетный источник?] для подводного плавания.
Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется при сварке в защитных газах, резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали. Аргон также применяется в люминесцентных лампах для предотвращения окисления разогретого вольфрамового электрода. Также, ввиду низкой теплопроводности, аргон (а также криптон) используют для заполнения стеклопакетов.
После крушения дирижабля «Гинденбург» в 1937 году огнеопасный водород был заменен негорючим гелием в качестве заполняющего газа в дирижаблях и воздушных шарах, несмотря на снижение плавучести на 8,6 % по сравнению с водородом. Несмотря на замену, катастрофа оказала непропорционально большое влияние на всю область герметичных летательных аппаратов легче воздуха и подорвала планы по расширению этой области авиации более чем на полвека. Они стали популярнее только в последнее время, с развитием нановолоконных тканей и альтернативной энергетики.
Активные
Защищают зону сварки от воздуха, но сами растворяются в жидком металле либо вступают с ним в химическое взаимодействие
Кислород (О2) — газ без цвета, запаха и вкуса. Негорючий, но активно поддерживающий горение. Технический газообразный кислород (ГОСТ5583-78) выпускается трех сортов: 1-й сорт — 99,7% кислорода; 2-й — 99,5%; 3-й — 99,2%. Применяется только как добавка к инертным и активным газам.
Углекислый газ (СО2) — бесцветный, со слабым запахом, с резко выраженными окислительными свойствами, хорошо растворяется в воде. Тяжелее воздуха в 1,5 раза, может скапливаться в плохо проветриваемых помещениях, в колодцах, приямках. Выпускается (ГОСТ 8050-85) трех сортов: высший-99,8% СО2, 1-й-99,5% и 2-й-98,8%. Двуокись углерода 2-го сорта применять не рекомендуется. Для снижения влажности СО2 рекомендуется установить баллон вентилем вниз и через 1-2 ч открыть вентиль на 8-10 с для удаления воды. Перед сваркой из нормально установленного баллона выпускают небольшое количество газа, чтобы удалить попавший внутрь воздух.
В углекислом газе сваривают чугун, низко- и среднеуглеродистые, низколегированные конструкционные коррозионностойкие стали.
Природный газ: состав
Если характеризовать качественный состав природного газа, то сразу нужно выделить компоненты двух групп: органические и неорганические. Поскольку хоть и принято считать, что он состоит из метана, однако это не совсем так.
К органическим составляющим относятся:
- метан — СН4;
- пропан — С3Н8;
- бутан — С4Н10;
- этан — С2Н4;
- более тяжелые углеводороды с количеством атомов углерода больше пяти.
Неорганические компоненты включают в себя следующие соединения:
- водород (в небольших количествах) — Н2;
- углекислый газ — СО2;
- гелий — Не;
- азот — N2;
- сероводород — H2S.
Каким именно будет состав той или иной смеси, зависит от источника, то есть месторождения. Этими же причинами объясняются и различные физико-химические свойства природного газа. Однако добывается любой из них, и ценность также имеет каждый. Просто какой-то вид применяется как топливо, а насыщенный посторонними примесями слишком жирно используется в химической отрасли для синтезов соединений.
Химические свойства
Неон, как и все благородные газы, имеет заполненную электронную оболочку. Все атомы благородных газов имеют на внешней орбите 8 электронов. Исключением является гелий (только 2 электрона)
Благородные газы не поддерживают горения и не возгораются при нормальных условиях.
| № | Элемент | № электронов/электронной оболочки |
|---|---|---|
| 2 | гелий | 2 |
| 10 | неон | 2, 8 |
| 18 | аргон | 2, 8, 8 |
| 36 | криптон | 2, 8, 18, 8 |
| 54 | ксенон | 2, 8, 18, 18, 8 |
| 86 | радон | 2, 8, 18, 32, 18, 8 |
Соединения
Структура тетрафторида ксенона XeF4, одного из первых когда-либо обнаруженных соединений благородных газов
Основная статья: Соединения благородных газов
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность (по сравнению с лёгкими инертными газами), но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона.
Оганесон, несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твёрдом состоянии.
Запасы природного газа
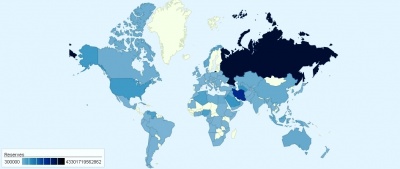 Карта запасов природного газа в мире
Карта запасов природного газа в мире
Метан и некоторые другие углеводороды широко распространены в космосе. Метан — третий по распространённости газ вселенной, после водорода и гелия. В виде метанового льда он участвует в строении многих удалённых от солнца планет и астероидов, однако такие скопления, как правило, не относят к залежам природного газа, и они до сих пор не нашли практического применения. Значительное количество углеводородов присутствует в мантии Земли, однако они тоже не представляют интереса.
Огромные залежи природного газа сосредоточены в осадочной оболочке земной коры. Согласно теории биогенного (органического) происхождения нефти они образуются в результате разложения останков живых организмов. Считается, что природный газ образуется в осадочной оболочке при больших температурах и давлениях, чем нефть. С этим согласуется тот факт, что месторождения газа часто расположены глубже, чем месторождения нефти.
Огромными запасами природного газа обладает Россия (Уренгойское месторождение), США, Канада. Из других европейских стран стоит отметить Норвегию, но её запасы невелики. Среди бывших республик Советского Союза большими запасами газа владеет Туркмения, а также Казахстан (Карачаганакское месторождение).
Во второй половине XX века в университете им. И. М. Губкина были открыты природные газогидраты (или гидраты метана). Позже выяснилось, что запасы природного газа в данном состоянии огромны. Они располагаются как под землёй, так и на незначительном углублении под морским дном.
| Страна | 2010 | 2006 | ||
| Добыча, млрд куб.м | Доля мирового рынка (%) | Добыча, млрд куб.м | Доля мирового рынка (%) | |
| Российская Федерация | 647 | 673,46 | 18 | |
| Соединенные Штаты Америки | 619 | 667 | 18 | |
| Канада | 158 | |||
| Иран | 152 | 170 | 5 | |
| Норвегия | 110 | 143 | 4 | |
| Китай | 98 | |||
| Нидерланды | 89 | 77,67 | 2,1 | |
| Индонезия | 82 | 88,1 | 2,4 | |
| Саудовская Аравия | 77 | 85,7 | 2,3 | |
| Алжир | 68 | 171,3 | 5 | |
| Узбекистан | 65 | |||
| Туркменистан | 66,2 | 1,8 | ||
| Египет | 63 | |||
| Великобритания | 60 | |||
| Малайзия | 59 | 69,9 | 1,9 | |
| Индия | 53 | |||
| ОАЭ | 52 | |||
| Мексика | 50 | |||
| Азербайджан | 41 | 1,1 | ||
| Остальные страны | 1440,17 | 38,4 | ||
| Мировая добыча газа | 100 | 3646 | 100 |
Координационная химия
Большинство металлов образуют координационные комплексы, содержащие ковалентно присоединенную окись углерода. Только металлы в низших степенях окисления будут соединяться с лигандами окиси углерода. Это связано с тем, что необходима достаточная плотность электронов, чтобы облегчить обратное пожертвование от металлической DXZ-орбитали, к π * молекулярной орбитали из СО. Неподеленная пара на атоме углерода в СО также жертвует электронную плотность в dx²-y² на металле для формирования сигма-связи. Это пожертвование электрона также проявляется цис-эффектом, или лабилизацией СО лигандов в цис-положении. Карбонил никеля, например, образуется путем прямого сочетания окиси углерода и металлического никеля:
Ni + 4 CO → Ni (CO) 4 (1 бар, 55 ° C)
По этой причине, никель в трубке или ее части не должен вступать в длительный контакт с окисью углерода. Карбонил никеля легко разлагается обратно до Ni и СО при контакте с горячими поверхностями, и этот метод используется для промышленной очистки никеля в процессе Монда.
В карбониле никеля и других карбонилах, электронная пара на углероде взаимодействует с металлом; окись углерода жертвует электронную пару металлу. В таких ситуациях, окись углерода называется карбонильным лигандом. Одним из наиболее важных карбонил металлов является пентакарбонил железа, Fe (CO) 5.
Многие комплексы металл-CO получают путем декарбонилирования органических растворителей, а не из СО. Например, трихлорид иридия и трифенилфосфин реагируют в кипящем 2-метоксиэтаноле или ДМФ, с получением IrCl (CO) (PPh3) 2.
Карбонилы металлов в координационной химии обычно изучаются с помощью инфракрасной спектроскопии.
Применение горючих газов
Горючие газы обладают высокой теплотой сгорания, а потому являются высокоэкономичным энергетическим топливом. Широко применяются для коммунально-бытовых нужд, на электростанциях, в металлургии, стекольной, цементной и пищевой промышленности, в качестве автомобильного топлива, при производстве строительных материалов.
Использование горючих газов в качестве сырья для производства таких органических соединений как формальдегид, метиловый спирт, уксусная кислота, ацетон, ацетальдегид, обусловлено наличием в их составе углеводородов. Метан, как основной компонент горючих природных газов, широко применяется для производства различных органических продуктов. Для получения аммиака и различного рода спиртов используется синтез-газ – продукт конверсии метана кислородом или водяным паром. Пиролизом и дегидрогенизацией метана получают ацетилен, наряду с водородом и сажей. Водород, в свою очередь, используется для синтеза аммиака. Горючие газы, и в первую очередь этан, применяют при получении этилена и пропилена, которые в дальнейшем используются в качестве сырья для производства пластмасс, искусственных волокон и синтетических каучуков.
Перспективным видом топлива для многих сфер народного хозяйства является сжиженный метан. Использование сжиженных газов во многих случаях дает большую экономическую выгоду, позволяя снизить материалозатраты на транспортировку и решить проблемы газоснабжения в отдельных районах, позволяет создавать запасы сырья для нужд химической промышленности.
Некоторые характеристики элементов VIIIА подгруппы (инертных газов).
|
Элемент |
Радиус атома, нм |
Первый потенциал ионизации, эВ |
Tпл., K |
Tкип., K |
Относительная поляризуемость атома, усл. ед. |
Энергия возбужденного электрона, эВ |
|
Гелий, He |
0,122 |
24,58 |
– |
4,18 |
1 |
– |
|
Неон, Ne |
0,160 |
21,56 |
24 |
27,18 |
2 |
16,6 |
|
Аргон, Ar |
0,192 |
15,76 |
34 |
97,29 |
3 |
11,5 |
|
Криптон, Kr |
0,198 |
14,00 |
116 |
120,26 |
12 |
9,9 |
|
Ксенон, Xe |
0,218 |
12,13 |
162 |
166,06 |
20 |
8,3 |
Уникальными физическими свойствами обладает гелий. Во первых, это — единственное из известных в природе веществ, которое остается жидким при самых низких температурах, вплоть до 0 К. Он кристаллизуется только под давлением 25 атм. Во-вторых, гелий имеет самую низкую из всех веществ температуру кипения. Наконец, самое интересное свойство гелия — сверхтекучесть. При температурах ниже 2,2 К жидкий 4Не существует в виде смеси двух жидкостей, одна из которых имеет обычные свойства, а другая — аномальные. Сверхтекучая компонента жидкого гелия имеет практически нулевую вязкость (в 10 млрд. раз меньше, чем у воды). Это вещество способно просачиваться через мельчайшие отверстия в пористом сосуде, оно самопроизвольно вытекает из непористого сосуда, поднимаясь вверх по его стенкам, и обладает сверхвысокой теплопроводностью.
Сжиженный газ и его роль
Среди веществ природного происхождения и технологического назначения выделяют такие, которые имеют высокую степень горючести и теплотворности. Для хранения, транспортировки и применения используются следующие виды сжиженного газа: метан, пропан, бутан, а также пропан-бутановые смеси.
Бутан (С4Н10) и пропан являются компонентами нефтяных газов. Первый сжижается при -1 – -0,5˚С. Транспортировка и применение в морозную погоду чистого бутана не осуществляется по причине его замерзания. Температура сжижения для пропана (С3Н8) -41 – -42˚С, критическое давление – 4,27 МПа.
Метан (СН4) – основная составляющая природного газа. Виды источника газа – залежи нефти, продукты биогенных процессов. Сжижение происходит с помощью поэтапного сжатия и снижения теплоты до -160 – -161˚С. На каждом этапе сжимается в 5-10 раз.
Сжижение осуществляется на специальных заводах. Выпускаются пропан, бутан, а также их смесь для бытового и промышленного использования по отдельности. Метан применяется в промышленности и в виде топлива для транспорта. Последний также может выпускаться и в сжатом виде.

Общие сведения о природном газе. Обзор природного газа.
Природный газ – общая информация
Природный газ, он же газ натуральный – это наиболее экологически чистый и экономически эффективный энергоноситель современности, не имеющей ни цвета, ни запаха. Характерный аромат бытового газа придается ему искусственно с целью возможности предотвращения его утечки и дальнейших неприятных последствий, связанных с взрывоопасностью данного вещества. Операция по введению в газ пахучих веществ называется одоризацией, а вводимое вещество – одорантом — В РФ это тиолы, в частности, этантиол = этилмеркаптан, часто просто «меркаптан».
Две основные концепции происхождения – биогенная и минеральная – утверждают разные причины образования углеводородных полезных ископаемых в недрах Земли:
- Минеральная теория. Образование полезных ископаемых в пластах горных пород – часть процесса дегазации Земли. Из-за внутренней динамики Земли углеводороды, находящиеся на больших глубинах, поднимаются в зону наименьшего давления, образуя в результате газовые залежи.
- Биогенная теория. Живые организмы, погибшие и опустившиеся на дно водоемов, разлагались в безвоздушном пространстве. Опускаясь все глубже из-за геологических движений, остатки разложившейся органики превратились под воздействием термобарических факторов (температуры и давления) в углеводородные полезные ископаемые, в том числе – в природный газ.
Природный газ может существовать:
- в виде газовых залежей, находящихся в пластах некоторых горных пород,
- в виде газовых шапок (над нефтью),
- в растворенном или кристаллическом виде,
- а также природный газ может находиться в виде газогидратов (гидраты природных газов – это газовые гидраты или клатраты – кристаллические соединения, образующиеся при определенных термобарических условиях из воды и газа).
Природный газ имеет ряд преимуществ по сравнению с другими видами топлива и сырья:
- стоимость добычи природного газа значительно ниже, чем других видов топлива; производительность труда при его добыче выше, чем при добыче нефти и угля;
- при газовом отоплении городов и населенных пунктов гораздо меньше загрязняется воздушный бассейн;
- при работе на природном газе обеспечивается возможность автоматизации процессов горения, достигаются высокие КПД;
- высокие температуры в процессе горения (более 2000°С) и удельная теплота сгорания позволяют эффективно применять природный газ в качестве энергетического и технологического топлива.
Химический состав (подробнее про природный газ — тут)
Химический состав природного газа достаточно прост. Основную часть этого вида газа составляет метан (CH4) – простейший углеводород (органическое соединение, состоящее из атомов углерода и водорода), его доля в среднем 92%.
В зависимости от содержания метана выделяются две основные группы природного газа:
- Природный газ группы H (Н–газ, т.е. высококалорийный газ) в связи с высоким содержанием метана (от 87% до 99%) является самым высококачественным. Российский природный газ относится к группе Н и отличается высокой теплотворной способностью. Ввиду высокого содержания метана (~ 98%) он является самым высококачественным природным газом мира.
- Природный газ группы L (L–газ, т.е. низкокалорийный газ) – это природный газ с менее высоким содержанием метана – от 80% до 87%. Если требования по качеству не выполняются (11,1 кВт-ч/куб.м), то часто газ нельзя поставлять непосредственно конечному потребителю без дополнительной переработки.
Помимо метана в состав природного газа могут входить более тяжелые углеводороды, гомологи метана: этан (C2H6), пропан (C3H8), бутан (C4H10) и некоторые неуглеводородные примеси
В то же время важно, что состав природного газа не постоянен и меняется от месторождения к месторождению
Физические свойства (подробнее про природный газ — тут)
Ориентировочные физические характеристики (зависят от состава):
- Плотность: от 0,7 до 1,0 кг/м3 (сухой газообразный, при нормальных условиях) либо 400 кг/м3 (жидкий).
- Температура возгорания: t = 650°C.
- Теплота сгорания одного м3 природного газа в газообразном состоянии при н.у.: 28-46 МДж, или 6,7-11,0 Мкал.
- Октановое число при использовании в двигателях внутреннего сгорания: 120-130.
- Легче воздуха в 1,8 раз, поэтому при утечке не собирается в низинах, а поднимается вверх.