Тема 4. виды горения
Содержание:
- Медленный тип горения
- Инициация реакции
- Горение веществ на воздухе и в кислороде
- Механизм процесса горения водорода
- Объем
- Уравнивание уравнения химической реакции
- Гетерогенное сгорание
- ПРЕИМУЩЕСТВА
- Признаки химической реакции
- Условия возникновения и виды горения
- Что такое горение и его продукт?
- Цианистый водород
- Турбулентная форма горения
- Применение водородной горючей смеси в технике: проблемы
- Особые виды
- Пламя
- 65. Виды горения, их характеристики
- Гратен из морских гребешков с моцареллой
- Химические свойства
- Теория горения
- Подводя итоги
Медленный тип горения
Процессам горения свойственно наличие тления, которое является его медленной формой. Поддержание такого явления осуществляется благодаря теплу, выделяемому в ходе взаимодействия O2 и горячего соединения в конденсированной форме, а реакции протекают на ее поверхности и подвергаются аккумулированию. Типичная ситуация, при которой наблюдается данное явление, — это тление сигареты. Здесь можно наблюдать медленное распространение вдоль материала. Нехватка высоты температуры обуславливает отсутствие газофазного пламени, а в ходе большой потери тепла сигарета начинает гаснуть. Чаще всего тление можно наблюдать в пористом или волокнистом ряде веществ.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 oC. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 oC.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Механизм процесса горения водорода
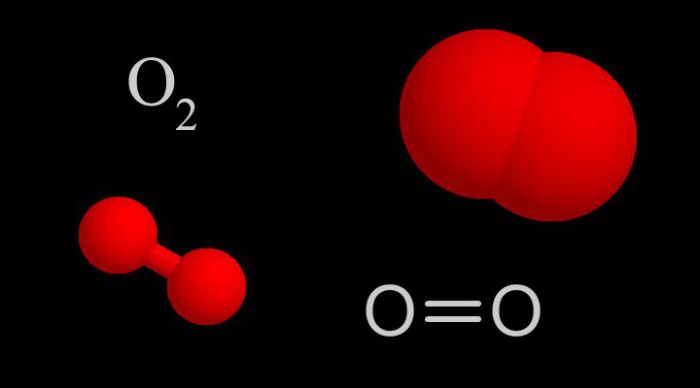
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
- H + O2 => OH + O;
- OH + H2 => H2O + H;
- O + H2 = OH + H.
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Объем
Теперь поговорим про те вещи, про которые нельзя забывать, говоря о продуктах, выбрасываемых при сгорании.
Объем продуктов горения – важная и очень полезная информация, которая, например, поможет определить уровень опасности сгорания того или иного вещества. То есть, зная объем продуктов, можно определить количество вредных соединений, входящих в состав выделившихся газов (как вы помните, большинство продуктов – газы).
Чтобы рассчитать искомый объем, в первую очередь нужно знать, был ли избыток или недостаток окислителя. Если, допустим, кислород содержался в избытке, то вся работа сводится к тому, чтобы составить все уравнения реакции. Следует помнить, что топливо, в большинстве случаев, содержит примеси. После высчитывается по закону сохранения массы количество вещества всех продуктов горения и, учитывая температуру и давление, по формуле Менделеева-Клапейрона, находится сам объем. Конечно, для ничего не смыслящего в химии человека все выше перечисленное выглядит страшно, но на самом деле ничего трудного нет, надо только разобраться. Подробнее на этом останавливаться не стоит, так как статья не об этом. При недостатке кислорода увеличивается сложность расчета – меняются уравнения реакций и сами продукты горения. Кроме того, сейчас используются более сокращенные формулы, но для начала лучше считать представленным способом (если это требуется), чтобы понять смысл вычислений.
Уравнивание уравнения химической реакции
Уже известная реакция водорода и кислорода также является реакцией горения. Если поджечь смесь двух этих газов, то произойдет взрывная реакция, в результате которой образуется вода.
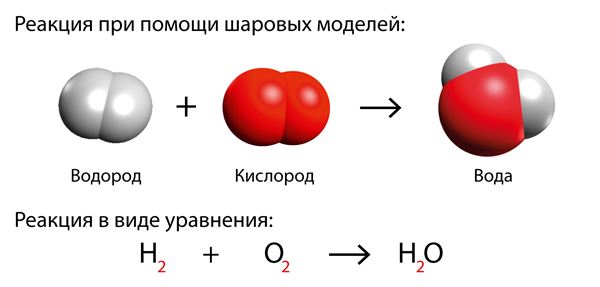
В уравнении молекула водорода и молекула кислорода имеют нижний индекс 2, так как они состоят из двух атомов. Молекула воды состоит из двух атомов водорода и одного атома кислорода.
Эта реакция не уравнена, поскольку число атомов в левой и правой частях не равно. Со стороны продуктов на один атом кислорода меньше. В реакции не может участвовать только один атом кислорода, поскольку атом кислорода не встречается самостоятельно. Таким образом, к продуктам следует добавить еще одну молекулу воды.
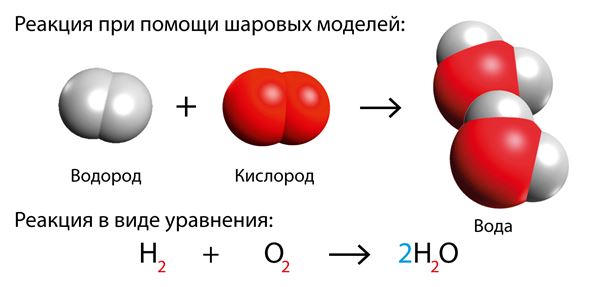
В молекуле воды нельзя приписать нижний индекс к кислороду, потому что получилось бы совсем другое вещество. Чтобы уравнять химическое уравнение, нужно поставить коэффициент 2 перед молекулой водорода.
Теперь справа на два атома водорода больше. Чтобы уравнять химическое уравнение, нужно добавить одну молекулу водорода слева.
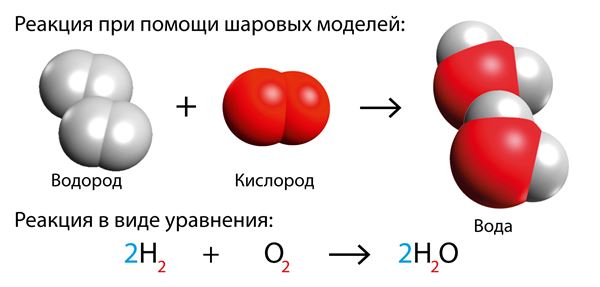
Чтобы уравнять химическое уравнение, нужно поставить коэффициент 2 перед молекулой водорода.
В уравнении химической реакции нижний индекс показывает число атомов, а коэффициент – число молекул.
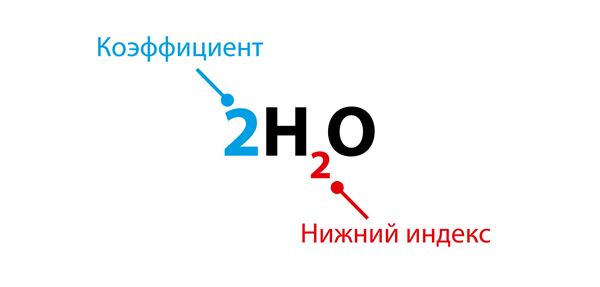
Коэффициент пишется перед формулой молекулы, а нижний индекс – справа снизу от символа элемента.
В формуле немолекулярного вещества нижний индекс показывает соотношение атомов в кристалле.
Гетерогенное сгорание
Еще одним видом горения веществ является гетерогенная реакция. Эти процессы являются противоположными гомогенным. Такое горение происходит в гетерогенной системе, то есть системе, содержащей более 1-й фазы (примером служат газ и жидкость). Также сюда включают процессы, протекающие в условиях границы фазового разделения. Очень часто под гетерогенным горением подразумевают химическую реакцию, в ходе которой ее реагент (топливо) испаряется, а процесс происходит в разных газовых фазах. Примером может послужить сгорание угля на воздухе. Здесь углерод способен реагировать с молекулами кислорода и образовывать угарный газ, который, в свою очередь, может догореть в газовой фазе и обусловить создание углекислого газа. Существует несколько типов гетерогенного горения, которые могут отличаться по механизму.
ПРЕИМУЩЕСТВА

Технология IonAir с системой MultiFlow 360°
Выберите полку. Любую полку.
Вентиляционная система MultiFlow 360° равномерно распределяет ионизированный воздух через 14 вентиляционных отверстий для поддержания постоянной температуры на каждой полке. Отрицательно заряженные ионы в воздухе устраняют неприятные запахи, имитируют природный микроклимат. Это создает идеальную среду для хранения свежих продуктов.
Больше
Скрыть

BridgeZone
Простое решение для больших кастрюль
Волшебное превращение двух отдельных конфорок в одну всего одним простым прикосновением. Приготовление блюд в большой посуде еще никогда не было таким простым и эффективным.

Сводчатая форма HomeMade
Немного магии — и идеальная выпечка готова!
Созданная по образцу традиционной дровяной печи, духовка округленной формы позволяет горячему воздуху свободно циркулировать, равномерно распределяясь по всему пространству. Так блюдо нагревается равномерно со всех сторон превосходно пропекаясь, становясь одновременно сочным и хрустящим.
Больше
Скрыть

16 комплектов посуды
Больше места, чем в шляпе волшебника
Удобная внутренняя камера предусматривает различные варианты загрузки посуды. Три корзины позволяют одновременно мыть до 16 столовых комлектов. Теперь можно устроить грандиозную вечеринку!

AdaptTech
Вы можете сосредоточиться на шоу
Сенсор, встроенный в вытяжку, определяет уровень примесей и автоматически регулирует скорость вращения вентилятора, а если вентилятор больше не нужен, выключает его. Поэтому вы можете полностью сосредоточиться на приготовлении вашего замечательного блюда.
Больше
Скрыть

Автоменю
Волшебное заклинание для простого приготовления блюд
Автоматические программы обеспечивают приготовление некоторых видов блюд. Вы вводите тип, вес продукта, а печь сама выбирает оптимальную мощность, продолжительность приготовления.
ORA ÏTOСОВЕРШЕНСТВО ДИЗАЙНА

Креативный французский дизайнер всегда был известен тем, что переворачивал привычные представления о дизайне, создавая нечто вечно прекрасное и простое. Эти характеристики полностью присущи кухонным приборам новой коллекции Gorenje.
Провокационные идеи стремительно вознесли Ора-Ито на вершину мирового дизайна. В начале своей карьеры он создавал образы вымышленных продуктов известных брендов, размещал их на собственном сайте. Люди стали заказывать товары, которые на самом деле не существовали. Крупные компании, такие как Louis Vuitton, Nike, Gucci, Swatch, Apple и Levi’s, могли подать в суд на молодого самозванца. Но были настолько впечатлены дизайном продуктов, что пригласили Ора-Ито к сотрудничеству.
Кухонные приборы, которые он создал совместно с Gorenje, получили широкое признание благодаря своему уникальному дизайну и невероятной практичности. Поэтому будут оставаться актуальными еще не одно десятилетие.
Photo: Ellen Von Unwerth
Признаки химической реакции
В процессе горения, в первую очередь, происходит выделение тепла и излучение света. В случае множества других химических реакций может также наблюдаться выпадение осадка, выделение запаха или газа и изменение цвета.

Признаками химической реакции при горении древесины являются выделение тепла и излучение света.

Признаком химической реакции при ржавлении железа является изменение цвета.

Признаком химической реакции при скисании молока является выделение запаха.

Признаком химической реакции также может являться выпадение осадка (на иллюстрации выпадение иодида свинца в осадок).

Признаком химической реакции также может являться выделение газа (на иллюстрации реакция магния с уксусной кислотой).
- Забивание гвоздей в стол.
- Выпекание торта в духовке.
- Горение бенгальских огней.
- Кипение воды.
- Изменение окраски листьев деревьев осенью.
- Свечение электролампочки.
- Появление тумана в летнее утро.
Условия возникновения и виды горения
Все разнообразие процессов горения может быть сведено к двум основным явлениям: возникновению и распространению пламени. Появлению пламени всегда предшествует процесс прогрессирующего самоускорсния реакции, вызванный изменением внешних условий: появлением в горючей среде источника зажигания, нагревом смеси горючего с окислителем до некоторой критической температуры стенками аппарата или в результате адиабатического сжатия и т. д.
Общая схема возникновения пламени показана на рис. 9.1. Зажигание горючей смеси инициируется внешним источником зажигания (электрической или фрикционной искрой, высоконагретой поверхностью, открытым пламенем). Если ограничиться рассмотрением зажигания газовой смеси искрой, то процесс зажигания может быть представлен в следующем виде.
Температура в канале электрической искры достигает 10000 °С. В этой зоне происходит термическая диссоциация и ионизация молекул, что приводит к интенсивному протеканию химических реакций. Однако, вызвав горение в зоне разряда, искра может не вызвать дальнейшего распространения пламени по смеси. Горючую смесь может зажечь только такая искра, в канале которой выделяется энергия, достаточная для обеспечения условий распространения пламени на весь объем смеси.
В модели зажигания, предложенной Я.Б. Зельдовичем, действие искрового разряда приравнено к действию точечного теплового источника, который в момент времени т = 0 выделяет Q кДж тепла.
За счет этого тепла он нагревает вокруг себя до достаточно высокой температуры сферический объем газа радиусом г. За счет теплообмена с окружающим газом температура первоначального объема будет понижаться. Критические условия зажигания искровым разрядом газовой смеси характеризуются следующим выражением:
, 9.1
где r — радиус начального ядра пламени; бпл — ширина фронта ламинарного пламени.
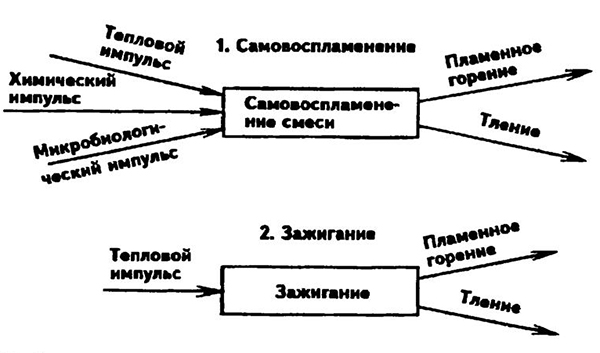
Рис. 9.1. Схема процессов самовоспламенения и зажигания
При выполнении условия (9.1) близлежащие слои горючей смеси успевают воспламениться прежде, чем нагретый искрой объем остынет.
Если для процесса зажигания решающими факторами являются температура источника зажигания и величина первоначально нагретого объема, то для процесса самовоспламенения основное значение имеют условия концентрации тепла. Процесс самовоспламенения будет рассмотрен далее.
При горении химически неоднородных горючих систем, т. е. систем, в которых горючее вещество и воздух не перемешаны и имеют поверхности раздела (твердые материалы и жидкости; струи паров и газов, поступающие в воздух), время диффузии кислорода к горючему веществу несоизмеримо больше времени, необходимого для протекания химической реакции. В этом случае процесс протекает в диффузионной области. Такое горение называют диффузионным. Все пожары представляют собой диффузионное горение.
Если время физической стадии процесса оказывается несоизмеримо меньше времени, необходимого для протекания химической реакции, то можно принять, что время сгорания химически неоднородной системы примерно равно времени протекания самой химической реакции. Скорость процесса практически определяется только скоростью химической реакции.
Такое горение называют кинетическим, например горение химически однородных горючих систем, в которых молекулы кислорода хорошо перемешаны с молекулами горючего вещества и не затрачивается время на смесеобразование. Поскольку скорость химической реакции при высокой температуре велика, горение таких смесей происходит мгновенно, в виде взрыва.
Если продолжительность химической реакции и физическая стадия процесса горения соизмеримы, то горение протекает в так называемой промежуточной области, в которой на скорость горения влияют как химические, так и физические факторы.
Пространство, в котором сгорают пары и газы, называется пламенем, или факелом. В случае, когда горит заранее не подготовленная смесь паров или газов с воздухом, пламя называют диффузионным. Если такая смесь образуется в пламени в процессе горения, — пламя кинетическое. В условиях пожара газы, жидкости и твердые вещества горят диффузионным пламенем.
Наиболее характерным свойством возникновения очага пламени является его способность к самопроизвольному распространению по горючей смеси. В понятие распространение пламени объединены разнообразные явления, сопровождающиеся образованием дефлаграционных (распространяющихся с дозвуковой скоростью) и детонационных (распространяющихся со сверхзвуковой скоростью) пламен.
Что такое горение и его продукт?
Бесконечно можно смотреть на три вещи: как течет вода, как работают другие люди и, конечно, как горит огонь…
Горение – это физико-химический процесс, основой которого является окислительно-восстановительная реакция. Сопровождается она, как правило, выбросом энергии в виде огня, тепла и света. В этом процессе принимают участие вещество или смесь веществ, которые горят, – восстановители, а также окислитель. Чаще всего эта роль принадлежит кислороду
Горение также можно назвать процессом окисления горящих веществ (важно помнить, что горение – подвид реакций окисления, а не наоборот)

Продукты горения – это все то, что выделяется во время сжигания. Химики в таких случаях говорят: «Все, что находится в правой части уравнения реакции». Но это выражение неприменимо в нашем случае, так как, кроме окислительно-восстановительного процесса, происходят также и реакции разложения, а некоторые вещества просто остаются неизменными. То есть продуктами горения являются дым, зола, копоть, выделяемые газы, в том числе и выхлопные. Но особым продуктом является, конечно, энергия, которая, как отмечено в прошлом абзаце, выбрасывается в виде тепла, света, огня.
Цианистый водород

Цианистый калий – сильнейший яд – соль синильной кислоты, также известной как цианистый водород – HCN. Это бесцветная жидкость, но очень летучая (легко переходящая в газообразное состояние). То есть при горении она тоже будет выделяться в атмосферу в виде газа. Синильная кислота очень ядовита, даже небольшая – 0,01 процент – концентрация в воздухе приводит к летальному исходу. Отличительной чертой кислоты является характерный запах горького миндаля. Аппетитно, не правда ли?
Но синильной кислоте присуща одна «изюминка» – отравиться ей можно, не только вдыхая непосредственно органами дыхания, но и через кожу. Так что защититься только противогазом не получится.
Турбулентная форма горения
Турбулентное г-ние – это «работа» над смесью, которую можно определять как турбулентную. Данная реакция является самой сложной для изучения, а также она крайне часто встречается в практических механизмах и устройствах. На сегодняшний день не существует законченной теории турбулентного горения, которая в полной мере способна была бы описать данный процесс.
Существует немало проблем, связанных с исследованием турбулентного горения. Например, взаимное влияние горения на турбулентность и наоборот приводит к тому, что процесс г-ния может как интенсифицироваться благодаря тепловыделению (сверх нормы), так и уменьшаться. Последнее обуславливается увеличением вязкости с ростом температуры.
Применение водородной горючей смеси в технике: проблемы
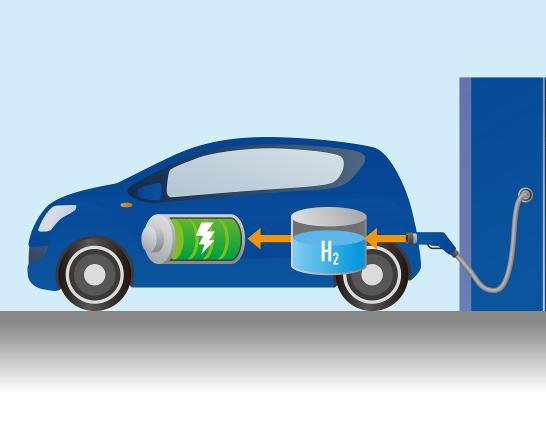
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.

Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Особые виды

Тление – особая форма медленного сгорания. Она поддерживаться благодаря выделяющемуся теплу в реакции молекул O2 с горячим конденсированным веществом. Реакция происходит на поверхности реагента и аккумулируется в фазе конденсации.
Твердофазным г-нием называются процессы, протекающие в порошках неорганической и органической природы. Эти явления относятся к автоволновым и экзотермическим. Они не сопровождаются заметным выделением газов.
Сгорание в пористых средах характеризуется тем, что сама среда, например керамическая матрица, нагревается благодаря расходу на это определенной части тепла. В свою очередь, матрицей подогревается исходная смесь. Здесь продукт рекуперируется.
Также существует беспламенное горение.
Пламя
Отвечая на вопрос о том, что такое горение, человек смог выделить в нем явление пламени, которое представляет собой зону, излучающую свет и образующуюся в ходе реакций горения. Ее температурные показатели определяются составом смесей и условиями, при которых протекает процесс. Сгорание природных газов позволяет разгонять температуру до двух тысяч кельвинов и выше.
Пламя многих видов топлива, основанных на углеводородах, обладает способностью к взаимодействию с электромагнитными полями. Это обуславливается наличием собственных частиц в заряженном состоянии. Посредством проведения экспериментов было доказано, что количество ионов в пламени может превышать в шесть порядков концентрацию анионов и катионов в процессах чистой термической ионизации. Главный механизм, отвечающий за образование ионов, — хемоионизация. Это сложный физико-химический процесс, который превращает исходные в продукты сгорания. В ходе экзотермической реакции выделяется большое количество тепла.

65. Виды горения, их характеристики
23.04.2009 22:36
Александр
Горение – это химический процесс соединения горючего вещества с окислителем, сопровождающийся интенсивным выделением теплоты и излучением света.Условием возникновения горения является превышение скорости выделения теплоты химической реакцией над скоростью отвода теплоты в окружающую среду. Если это условие обеспечивается, то происходит саморазогрев горючей смеси и скорость реакции увеличивается. И наоборот, превышение скорости отвода теплоты над скоростью ее выделения приводит к затуханию процесса горения.Различают несколько видов горения:• Вспышка – быстрое сгорание горючей смеси без образования повышенного давления газов.• Возгорание – возникновения горения от источника зажигания.• Воспламенение – возгорание, сопровождающееся появлением пламени.• Самовозгорание – горение, возникающее при отсутствии внешнего источника зажигания.• Самовоспламенение – самовозгорание, сопровождающееся появлением пламени.• Взрыв – чрезвычайно быстрое горение, при котором происходит выделение энергии и образование сжатых газов, способных производить механические разрушения.Горение газов является в диффузионной (когда кислород проникает в зону горения), так и в кинетической (однородная горючая смесь) области и может носить характер взрывного или детонационного (высокая скорость перемещения пламени) горения.При горении жидкости происходит её испарение и сгорание паровоздушной смеси над поверхностью жидкости. Определяющим является процесс испарения жидкости, который зависит от ее физико-химических свойств, теплового процесса в ней и т. п. Процесс горения паров не отличается от горения газов.Горение твердых веществ – гетерогенно-диффузионное (то есть горение в разных фазах с проникновением – плавление, разложение и испарение с выделением газообразных продуктов, которые образуют с воздухом горючую смесь).Повышенную пожарную опасность имеет пыль. Причем с увеличением дисперсности (это по сути насыщенность, отношение площади поверхности частиц к занимаемому ими объёму) пыли возрастает ее химическая активность, снижается температура самовоспламенения, что повышает ее пожарную опасность. Скорость горения высокодисперсной пыли приближается к скорости горения газа. Взрывоопасной является не только взвешенная, но и осевшая пыль, так как при воспламенении она переходит во взвешенное состояние, что приводит ко вторичным взрывам.Кратенько не получится 🙂
| Следующая > |
|---|
Гратен из морских гребешков с моцареллой

Ингредиенты
- 8 морских гребешков
- 1 лук-шалот
- 150 г белых грибов или лисичек
- 1 ломтик белого хлеба
- 250 мл сметаны
- 100 мл белого вина
- петрушка
- 100 г листьев шпината
- 20 г сливочного масла
- 100 г моцареллы
- оливковое масло
Подготовка
1 Откройте створки раковин и выньте мякоть. Оставьте несколько раковин. Гребешки промойте и оставьте в холодной воде на 10 минут. Слейте воду, обсушите моллюсков и выложите в жаропрочную посуду, смазанную маслом. Добавьте вино, накройте форму бумагой для выпечки и поставьте в печь на 4-5 минут при мощности микроволн 100%. Выньте форму из печи и выложите из нее гребешки.
2 Растопите масло в жаропрочной посуде при мощности микроволн 100% в течение 1-2 минут. Добавьте мелко порезанный лук-шалот и обжарьте 1-2 минуты при комбинации микроволн и конвекции. Добавьте грибы, порезанный кубиками хлеб и шпинат. Накройте и, не меняя режим, тушите 4-5 минут. Перемешайте, добавьте сметану, посолите, поперчите и готовьте на том же режиме еще 1-2 минуты. Выключите печь и оставьте блюдо внутри на 3 минуты.
3 Наполните раковины овощной смесью, сверху выложите гребешки, сбрызните оливковым маслом, посолите, поперчите и накройте ломтиком моцареллы.Выложите наполненные раковины в форму, поставьте на решетку в печь и запекайте на гриле 2-3 минуты. Посыпьте мелко порезанной петрушкой, украсьте долькой лимона и подавайте на стол.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).

Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).

При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).

Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).

При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Теория горения
Суть процесса горения, несмотря на большой практический опыт и применение, исследовалась в течение многих лет и остается одной из самых сложных загадок человечества. Наука, изучающая явление горения, является междисциплинарной и располагается на стыке газодинамики, химической термодинамики, химкинетики, молекулярной и химической физики, а также материаловедения и моделирования с использованием компьютерных технологий.
Рассмотрим следующие положения теории горения: полноту сгорания и его термодинамический механизм. Положение полноты сгорания включает в себя информацию о том, что исходные компоненты горючих смесей характеризуются молярной и массовой долей элемента, а также начальными показателями давления и температуры. Подобрав вещество, способное в ходе сгорания и окисления полностью превратиться в продукт рассматриваемого явления, можно получить стехиометрическую реакцию. Смесь, обладающая избытком горючего вещества, что не может полностью разложиться из-за нехватки окислителей, именуется богатой. Вещество с нехваткой топливного ресурса называют бедным.
Термодинамические данные позволяют нам утверждать, что горение, протекающее адиабатическим путем при наличии постоянного показателя объема, сохранит полную энергию внутренней системы. Если имеется постоянное давление, то наблюдается энтальпия структурных компонентов. Условия, при которых протекает адиабатическое давление, практически применяются и реализуются в пламени, что распространяется свободными путями. При этом расчетом теплопотери пренебрегают.
Подводя итоги
Анализируя полученную информацию, скажем, что слово «горение» означает химический процесс, взаимосвязанный с физическими явлениями. Он является главным источником энергии для всего населения планеты и основывается на сжигании различного вида топлив. Включает в себя множество разновидностей и имеет огромное значение для людей. Горение играло немаловажную роль в истории развития человечества, а детальное изучение его позволило стремительно расти технологическому процессу.
Изучением данного процесса занималось огромное множество ученых, а на достижение, систематизацию и обобщение всей информации ушло огромнейшее количество времени. Величайшие умы различных эпох и поколений совершили ценные вклады в общее развитие теории горения. Однокоренные с «горением» слова — это: горько, горы, горе, пригореть и прочее. Чаще всего гласная «о» пишется в корне тогда, когда на нее не падает ударение.