Свойства сернистого ангидрида
Содержание:
- Как SO2 используется в вине?
- 6. Воздействие на CD-R и DVD±R
- Получение
- Способы получения и производства сернистого газа
- Физические свойства
- Некоторые физические параметры диоксида серы
- Симптомы отравления диоксидом серы
- Практическое использование сернистого газа
- Первая помощь при отравлениях диоксидом серы
- Базовые добавки SO2 в зависимости от pH вина.
- Строение атома и свойства серы
- Биологическая роль
- Сернистый газ в природе
- Производители оборудования для получения и очистки сернистого газа
- Токсическое действие
- Воздействие на атмосферу
- Знайте pH, чтобы узнать свою молекулярную концентрацию SO2 !
- Систематические и тривиальные названия вещества
- Серный ангидрид и серная кислота
- Химические свойства
- Состав и особенности молекулярного строения SO2
Как SO2 используется в вине?
Соляные гранулы.
Диоксид серы обычно добавляют в вино в форме гранулированных солей метабисульфита или сульфита. Обычно, в винодельческой промышленности используется метабисульфит калия (KMBS). KMBS можно приобрести в магазине виноделия.
В зависимости от производителя, в KMBS содержится около 57,6% действующего вещества. Это соотношение необходимо учитывать при добавлении в сок или вино:
[(Желаемая концентрация SO2) / 0,576] x (объем вина) = (масса KMBS для добавления в вино)
Например, допустим, вы хотели добавить 50 мг / л или ppm (миллиграммов на литр или частей на миллион) SO2 в емкость с вином рассчитанную на 500 литров (л). Для расчета массы гранул метабисульфита калия необходимо добавить в винный резервуар:
[50 мг / л SO2 / 0,576] х 500 л = 43,403 мг или 43 г KMBS
Когда KMBS добавляется в вино, SO2 растворяется в связанной или свободной форме. Связанные формы являются «неактивными» и не обладают какими-либо антиоксидантными или антимикробными свойствами. Свободная форма SO2 является активной формой и способствует стабилизации вина. Две формы вместе (свободный плюс связанный) составляют общее количество SO2 в вине.
Вы знали?
Если виноделы часто добавляют SO2 в вино, но не видят изменений в концентрации свободного SO2; то вино, скорее всего, окислилось и содержит высокую концентрацию ацетальдегида, компонента окисления. Ацетальдегид легко связывается с вновь добавленным SO2 и предотвращает изменение концентрации свободного SO2.
Концентрация SO2 в вине находится в постоянном балансе и будет меняться, когда вино взбалтывается.
Рекомендуется контролировать концентрацию SO2 =:
- После ферментации и / или малолактической ферментации,
- При выдерке в дубовой таре,
- Во время хранения в резервуаре
- После доливок,
- До розлива,
- После розлива.
Для контроля качества желательна проверка концентрации свободного SO2 каждые 2-3 недели.
Предостережение: диоксид серы является опасным веществом, которое может выделять токсичные газы, особенно при вступлении в реакцию с кислотами или средами с низким pH
Рекомендуется особое обращение и осторожность. Обязательно сверьтесь с паспортом безопасности препарата
Жидкий запас.
Жидкий раствор диоксида серы (в воде) также можно добавлять в вина. Растворы 5-10 % удобны для одновременного внесения добавок SO2 в несколько различных вин. Исходные растворы следует готовить непосредственно перед использованием, так как они нестабильны в течение длительного периода времени.
Исходя из того, что KMBS состоит из 57,6% диоксида серы, добавление 1 г (г) KMBS к 1 л (л) воды будет равно 0,576 г SO2 в растворе. Концентрация этого раствора составляет 0,576 г / л (г / л) SO2 .
КАК ПРИГОТОВИТЬ 10-ПРОЦЕНТНЫЙ ИСХОДНЫЙ РАСТВОР SO2 .
Помните, что вам нужно примерно в два раза больше KMBS, чтобы получить желаемое количество SO2 , потому что KMBS содержит 57,6% SO2.. Поэтому для выяснения количества KMBS необходимо 100 грамм SO2 : 100 г SO2 / 0,576 = 174 г KMBS.
Используя 1-литровый контейнер (например, цилиндр, мерную колбу), добавьте соответствующее количество KMBS (для 10-процентного раствора это будет примерно 174 грамма KMBS). Затем заполните контейнер (не подогревая) дистиллированной водой или обратноосмотической водой до 1-литра, медленно растворяя KMBS в растворе.
Чтобы определить соответствующее количество SO2 для добавления в резервуар, используйте уравнение C1V1 = C2V2 , где C1 — концентрация SO в маточном растворе, V — объем добавляемого маточного раствора для резервуара, C2 — желаемая концентрация SO в резервуаре, а V — объем резервуара. Имейте в виду, что все единицы должны быть согласованны по концентрациям и объемам.
Например, винный резервуар имеет объем 500 литров, и вы ищете концентрацию SO2 100 мг / л в резервуаре. Сколько 10 процентов (100 г / л) исходного раствора SO2 вам нужно добавить в винный резервуар (при условии, что это первые 2 добавления)?
Сначала переведите 100 миллиграммов на литр в граммы на литр (100 мг / л = 0,1 г / л).
Используя уравнение C 1 V 1 = C 2 V 2 , подставьте в известную вам информацию и определите V 1 (объем исходного раствора, необходимый для добавления в винный резервуар):
C1V1 = C2V2
(100 г / л) (V1) = 0,1 г / л (500 л)
V1 = 0,5 л или 500 мл
Затем вы должны добавить 500 миллилитров (мл) 10-процентного исходного раствора в винный резервуар, чтобы сделать соответствующее добавление SO2 .
Хотя теоретически SO2 должен равномерно распределиться в вине, лучше хорошо перемешать вино, чтобы растворить SO2 во всем объеме резервуара. Рекомендуется проверить концентрацию свободного SO2 через 24 часа после добавления.
6. Воздействие на CD-R и DVD±R
Сернистый ангидрид или диоксид серы применяется, главным образом, в производстве серной кислоты, а также как восстановитель, отбеливатель, консервант, хладагент, антиоксидант. Из-за широкого использования является одним из основных газов, загрязняющих атмосферу. Большая часть тестов по оценке срока службы оптических дисков выполнены с записываемыми дисками (CD-R, DVD-R, DVD+R). Эти тесты обычно выполнены производителями с категоризацией дисков в зависимости от используемого в них металла и красящего вещества. В отражающем слое CD-R, DVD-R и DVD+R используется золото, серебро или сплав серебра вместо алюминия в ROM дисках. Золото не подвержено коррозии, но имеет высокую стоимость. Серебро обладает лучшей отражательной способностью и дешевле золота, но восприимчиво к коррозии если подвергнется воздействию сернистого ангидрида
, который загрязняет воздух и может проникнуть также как и кислород — с влажностью. Производители используют различные сплавы серебра, помогающие предотвращать коррозию, и в большинстве доступных на сегодня R-дисков используется сплав серебра в отражающем слое. Вероятность коррозии серебра от воздействия сернистого ангидрида меньше вероятности окисления алюминия, вызванной высокой влажностью. Несмотря на это, хранение диска в среде с отфильтрованным «чистом воздухом» может снизить или устранить воздействие диоксида серы. При надлежащем хранении, эти диски продержатся дольше технологии по их изготовлению .
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
-
- 2FeS2+5O2→2FeO+4SO2.{\displaystyle {\mathsf {2FeS_{2}+5O_{2}\rightarrow 2FeO+4SO_{2}}}.}
В лабораторных условиях и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:
-
- Na2SO3+H2SO4→Na2SO4+H2SO3,{\displaystyle {\mathsf {Na_{2}SO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}SO_{3}}},}
-
- H2SO3→H2O+SO2↑.{\displaystyle {\mathsf {H_{2}SO_{3}\rightarrow H_{2}O+SO_{2}\uparrow }}.}
Способы получения и производства сернистого газа
Существуют разнообразные способы получения диоксида серы, и каждый из них требует использование особых технических средств и приемов. Отличительной чертой каждого способа получения сернистого газа является применение различного серосодержащего материала.
Одним из способов получения диоксида серы является обжиг колчедана. При обжиге происходят разные химические процессы, а именно: реакция термического разложения дисульфида железа, вследствие чего образуется сульфид железа и происходит выделение серы, находящейся в парообразном состоянии. Выделение серы возникает при нагревании вещества до температуры в 500 С градусов, и с последующим повышением температуры только увеличивает свою интенсивность. Затем, пары серы сгорают, выделяя при этом диоксид серы. Образование сернистого газа при медленном окислении пирита происходит при температуре 170-260 С градусов. Температура воспламенения колчедана во многом зависит от степени того, насколько мелко он измельчен. Чем меньше, тем раньше колчедан воспламенится. Применение различных присадок и катализаторов позволяет регулировать температурные параметры.
Следующий способ получения сернистого газа – сжигание серы. Этот метод предполагает использование различных видов печей. Для того чтобы добиться оптимальной концентрации газа целесообразно использовать печи в распыленном состоянии. Данный метод получение диоксида серы в несколько раз эффективнее предыдущего способа. С теоретической точки зрения, при окислении серы 21% кислородом воздуха, на выходе можно получить тот же 21% сернистого газа. В том случае, если производить обжиг серы с незначительной подачей воздуха, то можно добиться получения газа с большой концентрацией SO2. На практике же, добиться таких результатов не представляется возможным из-за того, что такой процесс повлечет за собой резкий рост температуры, что недопустимо для печи.
Физические свойства
Оксид серы(VI) — в обычных условиях легколетучая бесцветная жидкость с удушающим запахом.
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм). При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи. Тип химической связи в молекуле: ковалентная полярная химическая связь.
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-Форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3.
Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Некоторые физические параметры диоксида серы
Оксид четырехвалентной серы при обычных показателях окружающей среды сохраняет газообразное агрегатное состояние. Формула сернистого газа позволяет определить его относительную молекулярную и молярную массы: Mr(SO2) = 64,066, М = 64,066 г/моль (можно округлять до 64 г/моль). Этот газ почти в 2,3 раза тяжелее воздуха (М(возд.) = 29 г/моль). Диоксид обладает резким специфическим запахом горящей серы, который трудно перепутать с каким-либо другим. Он неприятный, раздражает слизистые покровы глаз, вызывает кашель. Но оксид серы (IV) не такой ядовитый, как сероводород.
Под давлением при комнатной температуре газообразный сернистый ангидрид сжижается. При низких температурах вещество находится в твердом состоянии, плавится при –72…–75,5 °C. При дальнейшем повышении температуры появляется жидкость, а при –10,1 °C вновь образуется газ. Молекулы SO2 являются термически устойчивыми, разложение на атомарную серу и молекулярный кислород происходит при очень высоких температурах (около 2800 ºС).
Симптомы отравления диоксидом серы
Отравление диоксидом серы несколько похоже по симптоматике с отравлением сероводородом, но менее опасно. Симптомы начинают проявляться при концентрации сернистого раза выше 10мг/ м³. Сернистый газ бесцветен и имеет запах сгоревшей спички.
При легком отравлении ( до 0,002% в воздухе):
- Головокружение, нарушение координации;
- Жжение в глазах и носу, повышение слезоотделения, повышение кровотка в области носа и глотки;
- Першение в горле, потеря или осиплость голоса, сухой кашель и насморк.
При увеличении концентрации сернистого ангидрида приводят к химическим ожогам слизистых оболочек, трахеи и бронхов. У больных начинает прогрессировать одышка, их мучает кашель, они испытывают боли в горле и груди. Становится труднее глотать, наблюдаются нарушения речи. Больных начинает тошнить, иногда тошнота переходит в рвоту и даже рвоту с кровью. Человек испытывает общее утомление.
При остром отравлении (до 0,01 % в воздухе):
Развитие гнойного бронхита, токсического воспаления легких или эмфиземы, сопровождающееся расстройством сознания. Однако отмечается, что острая стадия встречается редко. Это связано с тем, что при попадании больших концентраций у человека рефлекторно начинается спазм голосовой щели и приступ удушья. Из-за этого человек волей-неволей захочет быстрее покинуть загазованное помещение, спасая себя от тяжелого отравления. Чего, например, не бывает в случае с сероводородом, к которому человек привыкает и перестает воспринимать при длительном контакте. Несмотря на это тяжелое отравление может привести к смерти в результате удушья и к слепоте.
Сжиженый сернистый ангидрид, попадая в глаза, сжигает роговицу, а попадая на кожу приводит к химическим ожогам.
При содержании сернистого ангидрида свыше 0,05% в воздухе при воздействии в течение 2-5 минут наступает смерть.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.
Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
Первая помощь при отравлениях диоксидом серы
Несмотря на похожесть симптомов с отравлением сероводородом, есть принципиальное отличие в оказании первой помощи. Если человек отравился оксидом серы, искусственное дыхание делать нельзя.
При таком отравлении нужно:
- Увезти человека из загазованной зоны;
- Сделать кислородную (60%) ингаляцию;
- Промыть теплой водой или содовым раствором пораженные участки кожи;
- Если повреждены глаза, закапать Дикаин 0,5%;
- Закапать сосудорасширяющие капли;
- При попадании внутрь промыть желудок теплой водой;
Лечить отравление оксидом серы в домашних условиях нельзя, при подозрениях необходимо вызвать «Скорую помощь».
Базовые добавки SO2 в зависимости от pH вина.
Когда pH становится ниже (≤ 3,0), в вино необходимо добавлять меньше SO2 , чтобы сохранить соответствующие молекулярные уровни. Вино, которое ближе по pH к 4,0; потребует гораздо больше SO2 , чтобы сохранить соответствующий молекулярный уровень. Например, при pH 3,0 необходим свободный SO2 13 мг / л, чтобы получить концентрацию молекулярного SO2 0,8 мг / л . При pH=4,0 необходим свободный SO2 125 мг / л, чтобы получить концентрацию молекулярного SO2 0,8 мг / л, которая будет ингибировать рост дрожжей и бактерий. Это соотношение можно увидеть с помощью уравнения выше.
При молекулярных уровнях ниже 0,5 мг / л SO2 не обеспечивает достаточной антимикробной защиты для обеспечения стабильности вина. При молекулярных уровнях выше 0,8 мг / л свободный SO2 может ощущаться как жжение или раздражение в носу.
Строение атома и свойства серы
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
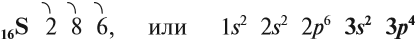
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
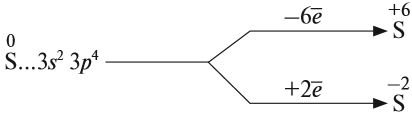
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
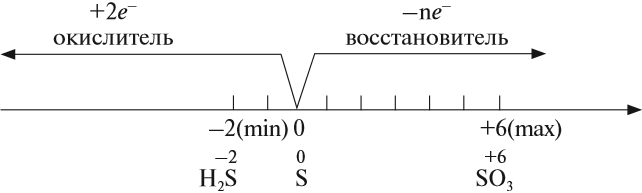
Иногда эти свойства проявляются в одной реакции:
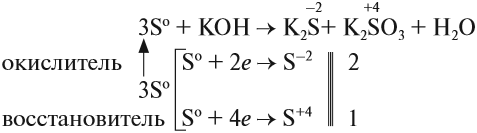
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.
Биологическая роль
Роль эндогенного сернистого газа в физиологии организма млекопитающих ещё окончательно не выяснена. Сернистый газ блокирует нервные импульсы от рецепторов растяжения лёгких и устраняет рефлекс, возникающий в ответ на перерастяжение лёгких, стимулируя тем самым более глубокое дыхание.
Показано, что эндогенный сернистый газ играет роль в предотвращении повреждения лёгких, уменьшает образование свободных радикалов, оксидативный стресс и воспаление в лёгочной ткани, в то время как экспериментальное повреждение лёгких, вызываемое олеиновой кислотой, сопровождается, наоборот, снижением образования сернистого газа и активности опосредуемых им внутриклеточных путей и повышением образования свободных радикалов и уровня оксидативного стресса
Что ещё более важно, блокада фермента, способствующего образованию эндогенного сернистого газа, в эксперименте способствовала усилению повреждения лёгких, оксидативного стресса и воспаления и активации апоптоза клеток лёгочной ткани. И напротив, обогащение организма подопытных животных серосодержащими соединениями, такими, как глютатион и ацетилцистеин, служащими источниками эндогенного сернистого газа, приводило не только к повышению содержания эндогенного сернистого газа, но и к уменьшению образования свободных радикалов, оксидативного стресса, воспаления и апоптоза клеток лёгочной ткани
Считают, что эндогенный сернистый газ играет важную физиологическую роль в регуляции функций сердечно-сосудистой системы, а нарушения в его метаболизме могут играть важную роль в развитии таких патологических состояний, как лёгочная гипертензия, гипертоническая болезнь, атеросклероз сосудов, ишемическая болезнь сердца, ишемия-реперфузия и др.
Показано, что у детей с врождёнными пороками сердца и лёгочной гипертензией повышен уровень гомоцистеина (вредного токсичного метаболита цистеина) и снижен уровень эндогенного сернистого газа, причём степень повышения уровня гомоцистеина и степень снижения выработки эндогенного сернистого газа коррелировала со степенью выраженности лёгочной гипертензии
Предложено использовать гомоцистеин как маркер степени тяжести состояния этих больных и указано, что метаболизм эндогенного сернистого газа может быть важной терапевтической мишенью у этих больных
Также показано, что эндогенный сернистый газ понижает пролиферативную активность клеток гладких мышц эндотелия сосудов, угнетая активность MAPK-сигнального пути и одновременно активируя аденилатциклазный путь и протеинкиназу A. А пролиферация гладкомышечных клеток стенок сосудов считается одним из механизмов гипертензивного ремоделирования сосудов и важным звеном патогенеза артериальной гипертензии, а также играет роль в развитии стеноза (сужения просвета) сосудов, предрасполагающего к развитию в них атеросклеротических бляшек.
Эндогенный сернистый газ оказывает эндотелий-зависимое вазодилатирующее действие в низких концентрациях, а в более высоких концентрациях становится эндотелий-независимым вазодилататором, а также оказывает отрицательное инотропное действие на миокард (понижает сократительную функцию и сердечный выброс, способствуя снижению артериального давления). Этот вазодилатирующий эффект сернистого газа опосредуется через АТФ-чувствительные кальциевые каналы и кальциевые каналы L-типа («дигидропиридиновые»). В патофизиологических условиях эндогенный сернистый газ оказывает противовоспалительное действие и повышает антиоксидантный резерв крови и тканей, например при экспериментальной лёгочной гипертензии у крыс. Эндогенный сернистый газ также снижает повышенное артериальное давление и тормозит гипертензивное ремоделирование сосудов у крыс в экспериментальных моделях гипертонической болезни и лёгочной гипертензии. Последние (на 2015 год) исследования показывают также, что эндогенный сернистый газ вовлечён в регуляцию липидного метаболизма и в процессы ишемии-реперфузии.
Эндогенный сернистый газ также уменьшает повреждение миокарда, вызванное экспериментальной гиперстимуляцией адренорецепторов изопротеренолом, и повышает антиоксидантный резерв миокарда.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO2 в атмосфере.
Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Производители оборудования для получения и очистки сернистого газа
Оборудование для получения и очистки сернистого газа производит узкое число производителей. С целью закупки соответствующих установок производителям нужно обращаться в специализированные компании, которые предоставляют услуги по обустройству и реконструкции промышленных предприятий.
Среди производителей можно отметить компании:
- «Дальневосточный завод энергетического машиностроения» (Дальэнергомаш), занимающийся производством нагнетателей сернистого газа 400-12-2, 700-13-1, 1050-13-1, Э 1700-11-2М;
- Российское приборостроительное предприятие «ОПТЭК» специализируется в области аналитического приборостроения и занимается выпуском хемилюминесцентного газоанализатора диоксида серы в атмосферном воздухе.
Токсическое действие
Оксид серы (IV) SO2 (диоксид серы) в высоких дозах очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Длительное воздействие диоксида серы в малых концентрациях также может нести вред организму. Системное исследование, проведённое в 2011 году показывает связь между воздействием диоксида серы на организм и преждевременными родами у женщин.
-
ПДК (предельно допустимая концентрация):
- в атмосферном воздухе максимально-разовая — 0,5 мг/м³, среднесуточная — 0,05 мг/м³;
- в помещении (рабочая зона) — 10 мг/м³.
По степени воздействия на человеческий организм сернистый ангидрид относится к III классу опасности («умеренно-опасное химическое вещество») согласно ГОСТ 12.1.007-76.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
По данным исследования средний порог восприятия запаха может превышать ПДК (21 мг/м3), а у части людей порог был значительно выше среднего значения.
Воздействие на атмосферу
Основная статья: Кислотный дождь
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие её в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида.
Необходимо отметить также, что диоксид серы имеет максимум в спектре поглощения света в ультрафиолетовой области (190—220 нм), что совпадает с максимумом в спектре поглощения озона. Это свойство диоксида серы позволяет утверждать, что наличие этого газа в атмосфере имеет также положительный эффект, предотвращая возникновение и развитие онкологических заболеваний кожи человека. Диоксид серы в атмосфере Земли существенно ослабляет влияние парниковых газов (диоксид углерода, метан) на рост температуры атмосферы.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
Знайте pH, чтобы узнать свою молекулярную концентрацию SO2 !
Содержание свободного диоксида серы состоит из трех частей: молекула SO2 , бисульфит (HSO3)SO2 , и сульфит (SO32-). Поскольку количество сульфитов весьма незначительно (менее 1 процента), процентное содержание свободного SO2 в сульфитной форме не часто рассчитывается. Большая часть (более 90 процентов) свободного SO2 состоит из бисульфитной формы, которая действует как антиоксидант в вине. Однако небольшая часть SO2 также будет существовать в виде молекулярной формы. Молекула SO2 является противомикробным агентом, который вносит вклад в концентрацию свободного диоксида серы. Молекулярный SO2 можно рассчитать с помощью следующего уравнения:
[Молекулярный SO2 ] = [Свободный SO2 ] /
Виноделам рекомендуется стремиться к концентрации молекулярного SO2 от 0,5 до 0,8 мг / л, так как именно это количество ингибирует рост большинства винных дрожжей и бактерий. Процент свободного SO2 , который находится в молекулярной форме, напрямую связан с pH вина. Поэтому, чтобы сделать точное добавление диоксида серы, виноделам также необходимо знать pH вина. Поскольку pH вина является различным, не рекомендуется делать стандартные концентрированные добавки SO2 для каждого вина.
Систематические и тривиальные названия вещества
Необходимо разобраться в многообразии терминов, относящихся к одному и тому же соединению. Официальное название соединения, химический состав которого отражает формула SO2, — диоксид серы. ИЮПАК рекомендует использовать этот термин и его английский аналог — Sulfur dioxide. Учебники для школ и ВУЗов чаще упоминают еще такое название — оксид серы (IV). Римской цифрой в скобках обозначена валентность атома S. Кислород в этом оксиде двухвалентен, а окислительное число серы +4. В технической литературе используются такие устаревшие термины, как сернистый газ, ангидрид сернистой кислоты (продукт ее дегидратации).
Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
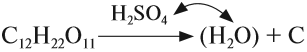
Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
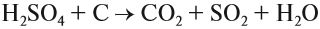
Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
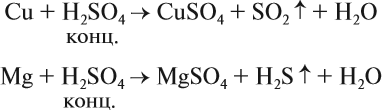
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
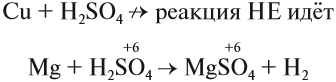
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.

Химические свойства
Спектр поглощения SO2 в ультрафиолетовом диапазоне.
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
-
- SO2+H2O⇄H2SO3.{\displaystyle {\mathsf {SO_{2}+H_{2}O\rightleftarrows H_{2}SO_{3}}}.}
С щелочами образует сульфиты:
-
- 2NaOH+SO2→Na2SO3+H2O.{\displaystyle {\mathsf {2NaOH+SO_{2}\rightarrow Na_{2}SO_{3}+H_{2}O}}.}
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
-
- SO2+Br2+2H2O→H2SO4+2HBr,{\displaystyle {\mathsf {SO_{2}+Br_{2}+2H_{2}O\rightarrow H_{2}SO_{4}+2HBr}},}
-
- SO2+I2+2H2O→H2SO4+2HI,{\displaystyle {\mathsf {SO_{2}+I_{2}+2H_{2}O\rightarrow H_{2}SO_{4}+2HI}},}
-
- 2SO2+O2→Pt450oC2SO3,{\displaystyle {\mathsf {2SO_{2}+O_{2}{\xrightarrow{450^{o}C}}2SO_{3}}},}
-
- 5SO2+2KMnO4+2H2O→2H2SO4+2MnSO4+K2SO4,{\displaystyle {\mathsf {5SO_{2}+2KMnO_{4}+2H_{2}O\rightarrow 2H_{2}SO_{4}+2MnSO_{4}+K_{2}SO_{4}}},}
-
- Fe2(SO4)3+SO2+2H2O→2FeSO4+2H2SO4.{\displaystyle {\mathsf {Fe_{2}(SO_{4})_{3}+SO_{2}+2H_{2}O\rightarrow 2FeSO_{4}+2H_{2}SO_{4}}}.}
Предпоследняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
-
- SO2+2CO→2CO2+S.{\displaystyle {\mathsf {SO_{2}+2CO\rightarrow 2CO_{2}+S}}.}
Или для получения фосфорноватистой кислоты:
-
- PH3+SO2→HP(OH)2+S.{\displaystyle {\mathsf {PH_{3}+SO_{2}\rightarrow HP(OH)_{2}+S}}.}
Состав и особенности молекулярного строения SO2
Молекула SO2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.