Сероводород
Содержание:
- 2. Свойства
- Физические свойства
- 5. Физиологические свойства
- Химические свойства
- Что мы узнали?
- Вред для организма человека
- Природа окислительно-восстановительных реакций серы и водорода
- 10.7 Отбор проб
- 11 Порядок выполнения измерений
- 12 Обработка результатов измерений
- 13 Оформление результатов измерений
- 14 Контроль точности результатов измерения
- Физические свойства
- Сероводород в бальнеологии
- Химические свойства
- Способы получения сероводорода
- Практическое использование сернистого газа
- Состав и особенности молекулярного строения SO2
- Сернистый газ в природе
- Отравляющее воздействие сероводорода на человека
- Какие газоанализаторы полагается применять для углеводородов
- Вред сероводорода и углекислого газа
- Немного цифр
- Физические свойства
2. Свойства
Сероводород немного тяжелее воздуха, смесь H 2 S и воздух — взрывоопасная. Сероводород в кислороде горит синим пламенем, с утвореннм SO 2 и воды. Всего сероводород действует как восстановитель. При высокой температуре или в присутствии катализатора, сероводород разлагается на элементарную серу и воду. Эта реакция известна процесс Клауса, основной способ преобразования сероводорода в элементарную сирку.Сирководень мало растворим в воде и действует как слабая кислота, дисоциюючы на гидросульфид ион HS — и сульфид ион S -. Сероводород реагирует с ионами металлов с образованием сульфидов, которые могут быть рассмотрены как соли сероводорода. Некоторые руды является сульфидами. Сульфиды металлов чаще всего имеют черный цвет. Бумага из ацетата свинца используется для обнаружения сероводорода, поскольку он реагирует с серой в присутствии газа с образованием сульфида свинца. Сульфиды металлов реагируя с сильной кислотой образуют сероводород. Сероводород реагирует со спиртами с образованием тиолов.
Физические свойства
Запах сероводорода, напоминающий тухлые яйца, знаком всем. При нормальных условиях данное вещество находится в газообразном состоянии. Оно не имеет цвета, плохо растворимо в воде, ядовито. В среднем при 20 градусах по Цельсию в воде будет растворяться 2,4 объема сероводорода. У сероводородной воды выявлены незначительные кислотные свойства, диссоциация вещества протекает ступенчато. Ядовитый сероводород опасен даже в незначительных дозах. Содержание в воздухе около 0,1 процента сероводорода приводит к параличу дыхательного центра с потерей сознания. Например, легендарный естествоиспытатель Плиний Старший погиб в 79 веке до нашей эры именно от сероводорода, который образовывался при извержении Везувия.
Причина отравляющего действия сероводорода в его химическом взаимодействии с гемоглобином крови. Железо, содержащееся в этом белке, образует сульфид с сероводородом.
Предельно допустимой концентрацией в воздухе сероводорода считается 0,01 мг/л. В качестве противоядия используется вдыхание чистого кислорода либо воздуха, в составе которого есть незначительное количество хлора.
Работа с сероводородом предполагает соблюдение определенных правил безопасности. Все эксперименты, касающиеся данного газообразного вещества, осуществляются в герметичных приборах и вытяжных шкафах.

5. Физиологические свойства
Сероводород образуется в небольших количествах в некоторых клетках млекопитающих и имеет ряд биологических сигнальных функций. (Только два других газы имеют такую же функцию: оксид азота (NO) и оксид углерода (СО). Газ образуется из цистеина под влиянием ферменте : цистатионин бета-синтазы и цистатионин гамма-лиазы. Он действует как розслаблювач гладких мышц и, как судинорозширювач, 0 также активно участвует в работе мозга, где он увеличивает реакцию рецепторов NMDA, и облегчает долгосрочное потенцирование, которое участвует в формировании памяти. Сульфаты выводятся с мочой. Благодаря своим эффектам близок к окиси азота, сероводород в наше время признан потенциальный защитник от сердечно-сосудистых заболеваний. Хотя оба оксида азота и сероводород, как было сказано расслабляют кровеносные сосуды, их механизмы действия различны: в то время как NO активирует фермент гуанилин-циклазу, H 2 S активирует АТФ -зависимые калиевые канальцы в клетках гладкой мускулатуры. Как оксид азота, сероводород участвует в расслабление гладких мышц, что вызывает эрекцию полового члена, это дает новые возможности для терапии эректильной дисфункции. При болезни Альцгеймера количество сероводорода в мозге сильно снижается. В трисомии 21 (наиболее распространенная форма синдрома Дауна) организм вырабатывает избыток сероводорода. Сероводород также участвует в процессе 1 типа диабета. Бета-клеток поджелудочной железы при сахарном диабете 1 типа вырабатывают избыток сероводорода, что приводит к гибели бета-клеток и снижение выработки инсулина теми, которые остались.
Химические свойства
Сернистый водород – мощный восстановитель. Основные химические свойства вещества описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
С кислородом |
Горит на воздухе голубым пламенем с образованием диоксида серы. При недостатке кислорода образуется сера и вода |
– 2H2S + 4O2 → 2H2O + 2SO2; – 2H2S + O2 → 2S + 2H2O |
|
С окислителями |
Окисляется до диоксида серы или серы |
– 3H2S + 4HClO3 → 3H2SO4 + 4HCl; – 2H2S + SO2 → 2H2O + 3S; – 2H2S + H2SO3 → 3S + 3H2O |
|
Со щелочами |
При избытке щёлочи образуются средние соли, при отношении 1:1 – кислые |
– H2S + 2NaOH → Na2S + 2H2O; – H2S + NaOH → NaHS + H2O |
|
Диссоциации |
Ступенчато диссоциирует в растворе |
– H2S ⇆ H+ + HS–; – HS– ⇆ H+ + S2- |
|
Качественная |
Образование чёрного осадка – сульфида свинца |
H2S + Pb(NO3)2 → PbS↓ + 2HNO3 |
Рис. 3. Горение сероводорода.
Сернистый водород – токсичный газ, поэтому его применение ограниченно. Большая часть производимого сероводорода используется в промышленной химии для производства серы, сульфида, серной кислоты.
Что мы узнали?
Из темы урока узнали о строении, получении и свойствах сероводорода или сернистого водорода. Это бесцветный газ с неприятным запахом. Является токсичным веществом. Образует сероводородную воду, не вступая во взаимодействие с водой. В реакциях проявляет свойства восстановителя. Реагирует с кислородом воздуха, сильными окислителями (оксидами, кислородными кислотами), со щелочами. Диссоциирует в растворе в два этапа. Сернистый водород используется в химической промышленности для изготовления производных веществ.
Вред для организма человека
Некоторые виды С2-С5 и С1-С10 способны оказывать на людей даже очень серьезное мутогенное влияние. Именно поэтому на предприятиях должны в точности соблюдаться нормативы в отношении ПДК в воздухе рабочей зоны углеводородов нефти и пр. В первую очередь такие соединения наносят вред сердечно-сосудистой системе человека. Также при длительном нахождении в среде с повышенной концентрацией углеводородов у людей обычно меняются в худшую сторону показатели крови. Прежде всего у пострадавших понижаются уровень гемоглобина и эритроцитов.
Также при превышении в воздухе ПДК углеводороды могут крайне негативно влиять и на печень людей. Помимо этого, такие соединения наносят значительный вред эндокринной системе. При длительном их воздействии у человека нарушается работа эндокринных желез. Кроме того, такие вещества оказывают крайне вредное воздействие на нервную систему и легкие.
В масштабах города углеводороды, помимо всего прочего, способны образовывать так называемый фотохимический смог. В процессе сложных превращений в атмосферном воздухе из соединений этого типа образуются крайне токсичные вещества. Это могут быть, к примеру, альдегиды или кетоны.
Природа окислительно-восстановительных реакций серы и водорода
Реакция образования сероводорода является окислительно-восстановительной:
Н₂⁰ + S⁰→ H₂⁺S²⁻
Процесс взаимодействия серы с водородом легко объясняется строением их атомов. Водород занимает первое место в периодической системе, следовательно, заряд его атомного ядра равен (+1), а вокруг ядра атома кружится 1 электрон. Водород с легкостью отдает свой электрон атомам других элементов, превращаясь в положительно заряженный ион водорода — протон:
Н⁰ -1е⁻= Н⁺
Сера находится на шестнадцатой позиции в таблице Менделеева. Значит, заряд ядра ее атома равен (+16), и количество электронов в каждом атоме также 16е⁻. Расположение серы в третьем периоде говорит о том, что ее шестнадцать электронов кружатся вокруг атомного ядра, образуя 3 слоя, на последнем из которых находится 6 валентных электронов. Количество валентных электронов серы соответствует номеру группы VI, в которой она находится в периодической системе.
Итак, сера может отдать все шесть валентных электронов, как в случае образования оксида серы(VI):
2S⁰ + 3O2⁰ → 2S⁺⁶O₃⁻²
Кроме того, в результате окисления серы, 4е⁻могут быть отданы ее атомом другому элементу с образованием оксида серы(IV):
S⁰ + О2⁰ → S⁺4 O2⁻²
Сера может отдать также два электрона c образованием хлорида серы(II) :
S⁰ + Cl2⁰ → S⁺² Cl2⁻
Во всех трех вышеуказанных реакциях сера отдает электроны. Следовательно, она окисляется, но при этом выступает в роли восстановителя для атомов кислорода О и хлора Cl.
Однако в случае образования H2S окисление — удел атомов водорода, поскольку именно они теряют электроны, восстанавливая внешний энергетический уровень серы с шести электронов до восьми. В результате этого каждый атом водорода в его молекуле становится протоном:
Н2⁰-2е⁻ → 2Н⁺,
а молекула серы, наоборот, восстанавливаясь, превращается в отрицательно заряженный анион (S⁻²):
S⁰ + 2е⁻ → S⁻²
Таким образом, в химической реакции образования сероводорода окислителем выступает именно сера.
С точки зрения проявления серой различных степеней окисления, интересно и еще одно взаимодействие оксида серы(IV) и сероводорода — реакция получения свободной серы:
2H₂⁺S-²+ S⁺⁴О₂-²→ 2H₂⁺O-²+ 3S⁰
Как видно из уравнения реакции, и окислителем, и восстановителем в ней являются ионы серы. Два аниона серы (2-) отдают по два своих электрона атому серы в молекуле оксида серы(II), в результате чего все три атома серы восстанавливаются до свободной серы.
2S-² — 4е⁻→ 2S⁰ — восстановитель, окисляется;
S⁺⁴ + 4е⁻→ S⁰ — окислитель, восстанавливается.
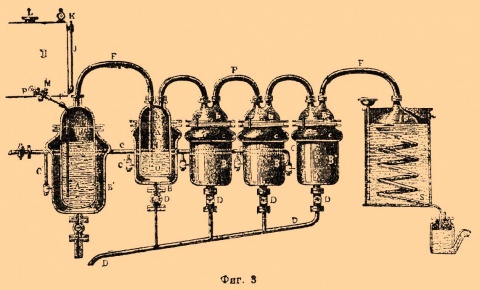
10.7 Отбор проб
10.7.1 Для определения разовой массовой концентрации
сероводорода исследуемый воздух протягивают через сорбционную трубку,
обработанную раствором для пропитки, с расходом 4 дм3/мин в течение
20 мин. При отборе сорбционная трубка должна быть укреплена в вертикальном
положении слоем сорбента вниз и защищена от света экраном из черной бумаги или
фольги. Отобранные пробы, защищенные от света, в герметичной упаковке могут
сохраняться от 2 до 3 дней,
10.7.2 Для измерения объема отобранной пробы используется
газовый счетчик, установленный в системе отбора между сорбционной трубкой и
электроаспиратором.
11 Порядок
выполнения измерений
Для определения массы сульфид-ионов в отобранных пробах
производят следующие операции:
— помещают сорбционную трубку с пробой в пробирку,
содержащую 4 см3 дистиллированной воды, 1 см3 раствора
ДФД и 1 каплю раствора хлорного железа;
— путем нескольких прокачиваний при помощи резиновой груши
переводят пробу в раствор, оставляют на 30 мин до полного развития окраски.
После этого сорбционную трубку вынимают, выдувая остатки раствора в пробирку;
— одновременно готовят три нулевые пробы, для чего
сорбционные трубки, обработанные пропитывающим раствором (из партии сорбционных
трубок подготовленных к отбору), анализируют аналогично пробам,
11.2 Массу сульфид-ионов в пробе находят по градуировочной
характеристике по разности измерений оптической плотности раствора пробы и
среднего значения трех нулевых проб. Измерения проводят в кюветах с расстоянием
между гранями 10 мм и длине волны 670 нм.
12 Обработка результатов измерений
12.1 Объем взятой на анализ
пробы воздуха приводят к нормальным условиям Vo,
дм3, по формуле
|
(3) |
где Vo — объем отобранной пробы воздуха, приведенной к
нормальным условиям (0 °С и 760 мм рт. ст. или 1013 гПа);
Vt — объем взятого на анализ воздуха при
температуре t и давлении Pi в месте отбора пробы, дм3;
Pi — атмосферное давление в месте отбора, мм рт.
ст. (гПа);
t — температура воздуха, аспирированного через ротаметр, °С;
Рo — атмосферное давление
при нормальных условиях (760 мм рт. ст. или 1013 гПа).
Примечание — 1 мм рт. ст. = 1,33 гПа.
12.2 Массовую концентрацию
сероводорода в исследуемом объеме воздуха С. мг/м3, находят по формуле
|
(5) |
где m — масса сульфид-ионов в
анализируемом объеме раствора пробы, найденная по градуировочному графику, мкг;
K* — коэффициент для пересчета массы
сульфид-ионов на массу сероводорода, равный 1,06;
Vo — объем воздуха, взятого на анализ,
приведенный к нормальным условиям, дм3.
Примечание —
Концентрация, выраженная в единицах величины мкг/дм3, численно равна
концентрации, выраженной в единицах величины мг/м3.
13 Оформление результатов измерений
13.1. Результаты анализа
представляют в виде
|
(6) |
где — измеренная
массовая концентрация определяемого вещества в воздухе, мг/м3;
δ — границы относительной погрешности (см.
таблицу )
13.2 Численное значение результата измерений округляется до
того же разряда, что и значение характеристики погрешности, которая приводится
со знаком «±» после результата измерения.
Пример
13.3 Если массовая концентрация сероводорода
ниже нижней границы диапазона измерений, производят следующую запись в журнале:
«Массовая концентрация сероводорода менее 0,006 мг/м3».
14 Контроль
точности результатов измерения
Физические свойства
Слайд. Водный раствор сероводорода проявляет свойства слабой кислоты. Основные месторождения самородной серы, способы получения и применение, пожароопасные свойства. Зарождение химии как науки. Общая характеристика халькогенов: история открытия, физические и химические свойства, получение и применение кислорода, серы, селена, теллура, полония и их соединений.

Сильное охлаждение переводит закись серы в оранжево-красное твердое вещество. Растворение в воде сопровождается выделением большого количества тепла и уменьшением объема. Для промышленного получения применяются два способа: нитрозный и контактный. Применяется почти во всех отраслях химической промышленности и в целом ряде других отраслей народного хозяйства. Сероводород H2S – ковалентное соединение, не образующее водородных связей, как молекула Н2О. (Разница в том, что атом серы больший по размеру и более электроотрицательный, чем атом кислорода.
И из-за отсутствия водородных связей температура кипения у H2S выше, чем у кислорода. Сероводород не толькоскверно пахнет, он еще и чрезвычайно ядовит. При вдыхании этого газа в большом количестве быстро наступает паралич дыхательных нервов, и тогда человек перестает ощущать запах – в этом и заключается смертельная опасность сероводорода.
Сероводород в бальнеологии
Выработка газа осуществляется в разных клетках нашего организма. По утверждению специалистов, проводивших экспериментальные опыты, важную роль молекула выполняет в сердечно-сосудистой системе. Она осуществляет регуляторное действие в артериях, участвуя в регуляции давлении. Несмотря на наличие токсического действия, бесцветный газ в ограниченных дозировках также борется с многочисленными патологическими процессами.

Его дефицит приводит к необратимым физиологическим последствиям, вызывая заболевание Альцгеймера (потерю памяти). Сероводород, влияние на организм которого хорошо изучено, обладает бактерицидными, противовоспалительными и ранозаживляющими свойствами. Сульфидные ванны разной крепости способствуют укреплению защитных сил, оказывают анестезирующее действие. Их терапевтическая сфера довольна обширна. Несколько таких процедур значительно улучшают обмен веществ, нормализуют метаболические процессы в мембране клеток и очищают от накопившихся шлаков. Под воздействием биомолекул восстанавливается психоэмоциональное состояние, исчезают беспочвенные страхи, приходит в норму давление.
Положительный эффект ванны оказывают в первую очередь на коронарный кровоток и опорно-двигательный аппарат. После 2-минутного соприкосновения с газообразным сульфидом водорода наблюдается интенсивное покраснение кожи: расширяются капиллярные петли, улучшается циркуляция крови. Восстанавливается подвижность в больных конечностях.
Химические свойства
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
-
- H2S→HS−+H+{\displaystyle {\mathsf {H_{2}S\rightarrow HS^{-}+H^{+}}}}Ka = 6,9⋅10−7 ; pKa = 6,89.
Реагирует со щелочами:
-
- H2S+2NaOH→Na2S+2H2O{\displaystyle {\mathsf {H_{2}S+2NaOH\rightarrow Na_{2}S+2H_{2}O}}} (средняя соль, при избытке NaOH)
- H2S+NaOH→NaHS+H2O{\displaystyle {\mathsf {H_{2}S+NaOH\rightarrow NaHS+H_{2}O}}} (кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. Окислительно-восстановительные потенциалы:
-
- S+2e−→S2−(Eh=−0.444B){\displaystyle {\mathsf {S+2e^{-}\rightarrow S^{2-}(Eh=-0.444B)}}}
- S+2H++2e−→H2S(Eh=0.144B){\displaystyle {\mathsf {S+2H^{+}+2e^{-}\rightarrow H_{2}S(Eh=0.144B)}}}
В воздухе горит синим пламенем:
-
- 2H2S+3O2→2H2O+2SO2{\displaystyle {\mathsf {2H_{2}S+3O_{2}\rightarrow 2H_{2}O+2SO_{2}}}}
при недостатке кислорода:
-
- 2H2S+O2→2S+2H2O{\displaystyle {\mathsf {2H_{2}S+O_{2}\rightarrow 2S+2H_{2}O}}} (на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или ион SO42−, например:
-
- 3H2S+4HClO3→3H2SO4+4HCl{\displaystyle {\mathsf {3H_{2}S+4HClO_{3}\rightarrow 3H_{2}SO_{4}+4HCl}}}
- 2H2S+SO2→2H2O+3S{\displaystyle {\mathsf {2H_{2}S+SO_{2}\rightarrow 2H_{2}O+3S}}}
- H2S+H2O2→2H2O+S{\displaystyle {\mathsf {H_{2}S+H_{2}O_{2}\rightarrow 2H_{2}O+S}}}
Качественной реакцией на сероводородную кислоту и её соли является их взаимодействие с солями свинца, при котором образуется чёрный осадок сульфида свинца, например:
-
- H2S+Pb(NO3)2→PbS↓+2HNO3{\displaystyle {\mathsf {H_{2}S+Pb(NO_{3})_{2}\rightarrow PbS{\downarrow }+2HNO_{3}}}}
При пропускании сероводорода через человеческую кровь она чернеет, поскольку гемоглобин разрушается и железо, входящее в его состав и придающее крови красный цвет, вступает в реакцию с сероводородом и образует чёрный сульфид железа.
Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов и растворимой соли сероводородной кислоты, например сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для всех щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са2+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, в водном растворе растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.), часто проходит необратимо с выпадением в осадок нерастворимого гидроксида.
Сульфиды применяются в технике, например полупроводники и люминофоры (сульфид кадмия, сульфид цинка), смазочные материалы (дисульфид молибдена) и др.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь, молибденит).
Пример окисления сульфида перекисью водорода:
-
- PbS+4H2O2=PbSO4+4H2O{\displaystyle {\mathsf {PbS+4H_{2}O_{2}=PbSO_{4}+4H_{2}O}}}
Способы получения сероводорода
Каково получение сероводорода в лаборатории? Самым распространенным вариантом является взаимодействие водорода с серой. Данная химическая реакция относится к соединению, проводится в вытяжном шкафу.
Кроме того, получение сероводорода возможно и при обмене между твердым сульфидом железа (2) и раствором серной либо соляной кислоты. Чтобы получить такой результат, в пробирку достаточно взять несколько кусков сульфида, не превышающих по размеру горошину. Далее в пробирку (до половины объема) добавляют раствор кислоты, закрывают газоотводной трубкой. Прибор помещают под вытяжку, пробирку нагревают. Химическое взаимодействие сопровождается выделением пузырьков газа. Такое получение сероводорода позволяет создавать количество вещества, достаточное для рассмотрения его химических свойств.
Какие еще бывают способы? В лаборатории допускается получение сероводорода путем взаимодействия металлического железа (под вытяжкой) с кристаллической серой, с последующим взаимодействием сульфида с серной кислотой.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.
Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
Состав и особенности молекулярного строения SO2
Молекула SO2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO2 в атмосфере.
Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Отравляющее воздействие сероводорода на человека
Существует два пути отравления сероводородом:
- вдыхание;
- контакт с кожей или слизистыми.
На клеточном уровне вещество связывается с железом в молекулах и подавляет цитохромоксидазы в митохондриях, блокирует доставку кислорода.
Отравление появляется, когда процесс накопления сульфидов превышает возможности организма по их выведению. Вещество легко растворяется в жирах, потому беспрепятственно проникает в любые клетки, особенно центральной нервной системы и легких.
Спектр проявлений зависит от концентрации и продолжительности воздействия сероводорода на организм человека.
Острое отравление, связанное с высокими дозами токсина, имеет несколько форм:
- Легкая:
проявляется раздражением слизистых и дыхательных путей. Человек ощущает резь в глазах, першение и царапание в горле, становится чувствителен к цвету. Может усиливаться кашель, насморк, наступать бронхоспазм. Внешне проявляется покраснением глаз, спонтанным морганием и закрытием (блефароспазмом). - Средняя:
проявляется, когда вещество проникает через легкие в кровь. Человек испытывает головную боль, головокружение, слабость, тошноту и рвоту, диарею. Может нарушаться координация движений, склонность к возбуждению и обморокам. Внешне проявляется синюшностью губ. Врач обнаруживает повышение давления, ускорение пульса. Анализ мочи выявляет белок и цилиндрические клетки. Иногда повышается температура, появляются симптомы бронхита и воспаления легких. - Тяжелая:
сильная рвота, посинение кожи, нарушение работы сердца и удушье. Глубокое коматозное состояние обычно заканчивается смертью. Если человек то впадает в глубокий сон, то просыпается, это говорит о благоприятном исходе. Проявляется интоксикация апатией, астенией, оглушенностью, постепенно развивается поражение центральной нервной системы. Возможно развитие отека легкого.
Подострая интоксикация действует медленнее, постепенно нарастают головные боли, слабость или утомляемость. Человек испытывает потливость, слизистые оболочки рта краснеют, и при глотании появляется боль. Глаза пересыхают, развивается конъюнктивит. Повышается отделение слюны, тошнота, живот болит приступообразно, развивается диарея с характерным стулом черно-зеленого цвета.
Хроническое отравление
Низкий уровень воздействия сероводорода — не редкость. В некоторых странах разработаны стандарты для промышленных выбросов в атмосферу. Воздействие в жилых домах не рассматривается на уровне государства, хотя близлежащие заводы и сельскохозяйственные объекты, разработки нефти и газа, очистные сооружения загрязняют питьевую воду, особенно в сельской местности, где лечение не проводится.
Признаки отравления сероводородом зависят от скопления сероводорода в атмосферном воздухе. При малоинтенсивном воздействии человек испытывает раздражение глаз и слизистых оболочек, но в целом организм не страдает. Осложнения возникают после вдыхания сероводорода в концентрации выше 1000 мг/м3 в атмосферном воздухе:
- острый респираторный дистресс-синдром;
- острый инфаркт миокарда;
- нервно-психические осложнения.
Проявления долгосрочных неврологических осложнений не изучены, поскольку в большинстве случаев воздействие сероводорода приводит к смерти. После острого или подострого отравления появляется склонность к болезням желудочно-кишечного тракта, бронхов и легких, сердечным патологиям и инфаркту, органическим поражениям центральной нервной системы. Иногда из-за влияния на организм сероводорода человек испытывает только головные боли.
Какие газоанализаторы полагается применять для углеводородов
Для этого цели на предприятиях газовой, нефтяной, химической промышленности нормативы допускают использовать контролирующие приборы следующих разновидностей:
- фотоионизационные;
- с недисперсными инфракрасными детекторами.
В наше время для контроля за атмосферным воздухом в цеху при этом чаще всего применяются специальные ИК-детекторы. В таких приборах концентрация углеводородов измеряется по интенсивности поглощения ИК-излучения на одной длине волны. К примеру, содержание соединений С2-С10 в воздухе определяется по поглощению на длине 3.4 мкм. Связано это в первую очередь с валентными колебаниями связей С-Н алкильных групп.
Идентификация углеводородов с использованием ИК-детекторов возможна только при условии измерения полного спектра поглощения в ИК-области. Также такие приборы не могут обеспечивать селективное определение концентрации алифатических углеводородов С2-С10. Такой контроль на предприятии обеспечивается посредством газовой хроматографии (разделение смесей летучих соединений).
Вред сероводорода и углекислого газа
Эти два вещества для организма человека при определенных условиях могут становиться очень опасными. Нахождение в среде, насыщенной сероводородом в концентрации 0.006 мг/дм3 в течение 4 часов, к примеру, может привести к таким негативным последствиям, как:
- головная боль;
- светобоязнь;
- насморк;
- слезотечение.
При повышении же концентрации до 0.2-0.28 мг/дм3 у человека наблюдается жжение в глазах, раздражение в носу и зеве. Увеличение же количества сероводорода в 1 мг/дм3 приводит к острому отравлению, сопровождающемуся судорогами, потерей сознания и в конечном итоге оканчивающемуся смертью. В особенности тщательно на предприятиях должны соблюдаться нормативы в отношении ПДК смеси сероводорода с углеводородами. В комбинации эти вещества способны наносить людям еще больший вред, чем по отдельности.
Углекислый газ, образующийся при сгорании углеводородов, оказывает на организм человека прежде всего наркотическое влияние. Также это вещество раздражающие действует на слизистые людей. В результате его длительного воздействия у пострадавших наблюдаются следующие негативные симптомы:
- головокружение;
- кашель;
- повышение АД.
При вдыхании же очень высоких доз углекислого газа у человека может даже наступить смерть. К летальному исходу, к примеру, приводит пребывание в комнате, где концентрация этого вещества в воздухе достигает 20%.
Немного цифр
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности: 1-й – вещества чрезвычайно опасные; 2-й – вещества высокоопасные; 3-й – вещества умеренно опасные; 4-й – вещества малоопасные.
Сероводороду (H2S) — наиболее активному из серосодержащих соединений — присвоен второй класс опасности. По данным ВОЗ (Всемирной Организации Здравоохранения), он входит в перечень самых распространённых и наиболее опасных загрязнителей окружающей среды наряду с дихлорметаном, формальдегидом, стиролом, толуолом, мышьяком, окисью углерода, свинцом, фтором, ртутью т.п. Сероводород считается одним из самых нежелательных компонентов нефтепереработки.

В случае выброса предприятием этого отхода в окружающую среду может быть возбуждено дело, что наглядно продемонстрировал недавний случай с московским нефтеперерабатывающим заводом в Капотне, который подозревают в «обогащении» столичного воздуха сероводородом в количестве, превысившем ПДК (предельно допустимая концентрация) в 51(!) раз. Многочисленные жалобы населения на неприятный запах из окон, резь в глазах и привкус во рту и произведённые затем замеры воздуха не смогли оставить равнодушным даже видавший всякое Росприроднадзор.
Сероводород хорошо растворим в воде. Диапазон взрывоопасных концентраций в смеси его с воздухом достаточно широк и составляет от 4 до 45% об. При контакте с металлами (особенно если в газе содержится влага), сероводород вызывает сильную коррозию. Предельно допустимая концентрация сероводорода (H2S) в воздухе в рабочей зоне—10 мг/м3 (кубометр), в смеси с углеводородами —3 мг/м3.
Предельно допустимая норма сероводорода (H2S) в воздухе населенных мест—0,008 мг/м3 (миллиграмм на кубический метр)
Ощутимый запах сероводорода отмечается при концентрации 1,4—2,3 мг/м3, значительный запах —при 4 мг/м3, тяжелый запах при 7—11 мг/м3.
Бесцветный газ с неприятным запахом тухлых яиц, не только ядовит, но и коварен: при очень высоких концентрациях он уже после первых вдохов блокирует обонятельный нерв, и человек перестаёт чувствовать этот запах после того, как тот «ударил в нос». Острое отравление наступает уже при концентрациях 0,2–0,3 мг/л, а концентрация выше 1 мг/л — смертельна.
Смертельная концентрация этого газа в воздухе очень мала – всего 0,1%. Такое количество сероводорода может привести человека к летальному исходу за 10 минут. Стоит лишь немного увеличить концентрацию – и смерть наступает мгновенно, после первого же вдоха. Для примера: в канализационной системе концентрация сероводорода иногда достигает 16%.
Если речь идёт о незамкнутом помещении, сероводород не действует так резко и внезапно, не застаёт жителей врасплох. Однако, человеку свойственно привыкать к любому запаху, это некоторая защитная реакция нашего организма (например, жители мегаполисов не замечают специфический запах в метро, не замечают запах выхлопных газов, но при этом очень впечатляются свежестью приморского воздуха, будучи в отпуске). Именно с этим явлением сталкиваются периодически жители больших городов по всему миру, и в частности, Москвы, где в некоторых районах подобный запах – привычное дело.
Что касается промзон и градообразующих предприятий, известно, что люди, работающие или живущие в непосредственной близости от заводов с сероводородными (и иными) выбросами (в концентрациях от 0,02%), испытывают так называемое хроническое отравление. Выражается это, как правило, в стабильно плохом самочувствии, головных болях, потере веса, металлическом привкусе во рту (тревожный сигнал, посылаемый печенью), неприятными ощущениями в груди и даже обмороками, обострениях хронических заболеваний.

Поскольку экзогенный (вызываемый внешними причинами) сероводород попадает в организм через дыхательные пути, первый удар всегда принимает слизистая оболочка. Этот газ плохо действует и на глаза: может вызвать конъюнктивит, спровоцировать светобоязнь, раздражение слизистой оболочки глаз, снижение остроты зрения.
Физические свойства
Каждый человек, анализируя новое для себя вещество, в первую очередь обращает свое внимание на его физические свойства: агрегатное состояние, цвет, запах, прочее. Пожалуй, начать следует именно с запаха сероводорода, он известен всем — тухлые яйца
Конечно, назвать его приятным не сможет никто. Каковы физические свойства сероводорода, не смотря на его распространенность, известно только тем, кто работает с ним или прилежно учился в школе. При стандартных условиях вещество имеет газообразную структуру. Описать физические свойства сероводорода, и при этом не упомянуть об изменении его свойств при температуре свыше 20 градусов по Цельсию было бы огромным упущением, ведь именно при этих условиях возможно полное растворение сероводорода водой. Вода, содержащая это соединение, обладает незначительными кислотными свойствами, диссоциация имеет ступенчатый характер.
Для человека вещество достаточно опасно — оно является своего рода ядом, даже в незначительных количествах. Десятая часть процента газа сероводорода может привести к параличу дыхательных путей человека, что приводит к летальному исходу в течении 8 минут (именно такое время мозг способен жить без поступления нового кислорода).
Ядовитые свойства сероводорода распространяются на всех существ, в крови которых содержится гемоглобин. Железо, в большом количестве содержащиеся в эритроцитах, очень легко вступает в реакцию с молекулами сероводорода, образуя сульфид, который не может переносить кислород.
Противоядие к сероводороду очень просто — нужно всего лишь вдохнуть воздух, насыщенный кислородом и имеющий незначительную примесь хлора, который нейтрализует действие серы. Эксперименты и исследования, связанные с сероводородом должны проводится в специальных условиях.