Реакция аммиака, перманганата калия и серной кислоты
Содержание:
- Опасность повышенной кислотности
- Шаги
- Как утилизировать в домашних условиях
- Производство серной кислоты
- Определение свободной соляной кислоты в желудочном содержимом по Тепферу
- Методы исследования кислотности желудка
- Соляная кислота в желудочной жидкости
- Причины повышенной кислотности желудка
- Как понизить концентрацию аммиака/аммония в аквариуме?
- Кислоты
- Зоны продукции и нейтрализации кислоты в желудке
- Сода
Опасность повышенной кислотности
Одноразовое повышение содержания кислоты в пищеварительном органе не связывают с патологией. Обычно симптомы этого процесса проходят самостоятельно. Длительное ощущение изжоги и кислой отрыжки чревато хроническими осложнениями с поражением желудочных стенок. Несвоевременное устранение избыточной кислотности способно усилить опасность язвенного состояния слизистой до перфорации желудочных стенок с последующим перитонитом и, при его дальнейшем развитии, сепсисом. С целью предупреждения развития гастрита или язвы пациент нуждается в нейтрализации избытка отрицательных ионов сока желудка положительными ионами (катионами).
Шаги
Метод 1 из 3: Нейтрализация брызг аммиака
-
1
Если вы собираетесь иметь дело с большим количеством аммиака, приготовьте раствор для его нейтрализации заранее. Смешайте в равных пропорциях двууглекислый натрий, наполнитель для кошачьих туалетов и сухой песок. Храните эту смесь в ведре возле рабочего места. -
2
Закажите или сделайте сами пятипроцентный водный раствор соляной кислоты. При взаимодействии с каплями аммиака она вступит в химическую реакцию и нейтрализует аммиак. -
3
Распознавайте брызги аммиака как можно быстрее. Насыпьте на них приготовленную заранее смесь. При этом используйте достаточное количество смеси, так чтобы ее поверхность была сухой. -
4
Подождите, пока смесь впитает жидкость. -
5
При помощи совка соберите смесь в какую-либо емкость. При этом наденьте защитную повязку. Если возможно, поместите эту емкость под вытяжной шкаф. Запустите вытяжку и не выключайте до окончания процедуры. -
6
Заполните пластиковое ведро холодной водой. Медленно пересыпьте смесь в эту воду. -
7
Добавьте в воду пятипроцентный раствор соляной кислоты. Перемешайте раствор длинной палкой или стержнем. При реакции кислоты с аммиаком образуется хлористый аммоний (нашатырный спирт), являющийся менее вредным веществом. -
8
Слейте жидкость в раковину. Осадок выбросьте в лабораторное мусорное ведро.
Метод 2 из 3: Нейтрализация аммиака от домашних животных
-
1
Промокните свежее пятно мочи бумажными полотенцами. Потопчитесь по полотенцам, чтобы они лучше впитали жидкость. -
2
Смешайте белый уксус и воду в равных пропорциях.Не жалейте смеси и обрызгайте ею все места, где были пятна, но не переусердствуйте, чтобы она не затекла под половое покрытие.
Побрызгайте этой смесью или вылейте ее на место пятна. Если пятно было на ковре, используйте побольше смеси.
-
3
Выждите 10 минут. После этого опять протрите пол бумажными полотенцами. -
4
Дайте полу подсохнуть, чтобы он стал лишь слегка влажным. Затем посыпьте его пищевой содой. Оставьте соду на 15 минут. -
5
Пропылесосьте обработанные участки. Вы должны убрать основное количество мочи, которая выделяет аммиак. Если запах мочи все же остался, повторите процедуру, чтобы очистить пол от ее остатков. -
6
Приобретите средство для удаления пятен, оставленных домашними животными, или чистящее средство на основе ферментов. Применяйте средство, руководствуясь инструкциями на упаковке. В случае необходимости также повторяйте процедуру.
Метод 3 из 3: Нейтрализация аммиака в конюшне
-
1
Убедитесь, что ваши лошади находятся в хорошо проветриваемой конюшне, даже в зимнее время.Высокие концентрации аммиака могут привести к повреждению дыхательных путей и даже вызвать смерть.
Вентиляция только проходов недостаточна. В каждом стойле должно быть отверстие размером по меньшей мере 0,3 м (1 фут) для обеспечения нормального выхода избыточного аммиака наружу.
-
2
Очищайте стойла дважды в день, выводя лошадей из них. Выбрасывайте пропитанную мочой подстилку, заменяя ее на свежую. -
3
Мойте и протирайте стойла дважды в неделю. -
4
Стойла должны иметь соответствующую дренажную систему. Как правило, для этого на пол кладут маты. Мойте пол под матами каждую неделю. -
5
Для подстилки выберите материал, хорошо впитывающий влагу. Установлено, что белая солома понижает содержание аммиака. Кенафовое волокно также уменьшает количество аммиака. -
6
Смешайте свежую подстилку с веществом, нейтрализующим аммиак. В качестве такого вещества можно использовать диатомовую землю или субстанцию на основе клиноптилолита. Они повысят поглощающую способность подстилки и уменьшат содержание бактерий, производящих аммиак.
Как утилизировать в домашних условиях
Чаще всего в быту мы сталкиваемся с аммиаком в виде раствора – нашатырного спирта. Ненужный аммиачный раствор в большинстве случаев просто сливается в канализацию. Однако это не совсем правильно, слова слив и утилизация аммиака не должны быть синонимами. В домашних условиях сгладить негативное влияние нашатырного спирта можно с помощью реакции нейтрализации. При этом к аммиачному раствору следует прилить, например, уксусную кислоту. В результате образуется ацетат аммония и вода (реакция обратимая)
Важно учитывать, что оба вещества имеют резкий запах, поэтому проводить нейтрализацию лучше на открытом воздухе с соблюдением мер предосторожности

Утилизация аммиачных отходов – важный вопрос в области охраны окружающей среды. Все крупные и маленькие предприятия должны правильно утилизировать образующийся аммиак. Только искреннее понимание данной проблемы и ответственный подход к ее решению внесут свой посильный вклад в сохранение нормальной экологической обстановки на нашей планете.
Производство серной кислоты
В качестве серосодержащего сырья для производства серной кислоты могут быть использованы сера или сероводород (побочные продукты нефтепереработки), минерал пирит FeS2, а также сульфиды некоторых других d-элементов. Никакие другие виды сырья не используются.
В настоящий момент основным сырьем для производства серной кислоты являются сероводород и сера, поскольку они в огромных количествах образуются в качестве побочных продуктов нефтепереработки.
Однако же в школьной программе пока еще по-прежнему считается, что серная кислота производится преимущественно из пирита, в связи с чем и мы будем рассматривать основные стадии производства серной кислоты именно этого же сырья.
Первая стадия
Заключается в сжигании предварительно измельченного пирита в токе обогащенного кислородом воздуха. Процесс протекает в соответствии с уравнением:
Обжиг осуществляют при температуре около 800 оС в печи для обжига. В процессе обжига используют так называемый метод кипящего слоя – частицы измельченного пирита подаются в печь сверху, а воздух — снизу. В результате этого раскаленные частицы пирита оказываются подвешенными в токе воздуха, внешне напоминая кипящую жидкость.
После обжига пирита полученный печной газ, содержащий диоксид серы, отделяется от твердых примесей огарка (Fe2O3) с помощью циклона. Циклоном называют аппарат, в котором происходит грубая очистка печных газов за счет центробежной силы от наиболее крупных твердых частиц. Далее после грубой очистки смесь газов проходит более глубокую очистку уже от оставшихся мелких твердых частиц с помощью электрофильтра. Принцип действия электрофильтра основан на том, что к наэлектризованным металлическим пластинам прилипает пыль, которая после скопления ссыпается с них под собственным весом в приемник.
После очистки от твердых примесей печной газ направляется в нижнюю часть так называемой сушильной башни, в верхнюю часть которой впрыскивается концентрированная серная кислота на встречу газу. При таком варианте осуществления фактически сталкиваются два потока — смеси газов, идущей снизу, и струи жидкой концентрированной серной кислоты, текущей сверху. Очевидно, что в результате этого достигается максимальная степень «смешения» газа с осушающей жидкостью. Данный прием носит название принципа противотока.
Вторая стадия
После очистки от твердых примесей и осушки концентрированной серной кислотой газы поступают в контактный аппарат. В контактном аппарате расположены полки с катализатором V2O5, который катализирует взаимодействие диоксида серы с кислородом в соответствии с уравнением:
Аналогично реакции взаимодействия азота с водородом, рассмотренной выше, данная реакция также является каталитической, экзотермической и протекает с уменьшением количества газообразных веществ. Поэтому с точки зрения принципа Ле Шателье ее следовало бы проводить при низких температурах. Однако при низких температурах скорость реакции крайне низка, и ее осуществляют при оптимальной температуре около 400-500 оС. Смещения равновесия реакции в сторону разложения SO3 при повышении температуры удается практически полностью избежать, проводя реакцию при повышенном давлении.
Третья стадия (заключительная)
После второй стадии образовавшийся триоксид серы поступает в часть установки, называемую поглотительной башней.
Из названия данного аппарата логичным было бы предположить, что триоксид серы в нем поглощается в этой части установки водой, ведь триоксид серы, взаимодействуя с водой, образует серную кислоту. Однако в реальности серный ангидрид SO3поглощают не водой (!!!), а концентрированной серной кислотой. Связано это с тем, что при смешении серного ангидрида с водой выделяется колоссальное количество теплоты, в результате чего сильно возрастают температура, давление и образуются мельчайшие капли трудноуловимого сернокислотного тумана.
В результате поглощения SO3 концентрированной серной кислотой фактически образуется раствор SO3 в безводной серной кислоте, который называют олеумом. Далее образующийся олеум собирается в металлические емкости и отправляется на склад. Серную кислоту необходимой концентрации получают, добавляя к олеуму воду в нужной пропорции. В результате добавления воды избыток SO3 превращается в серную кислоту.
Определение свободной соляной кислоты в желудочном содержимом по Тепферу
Для определения кислотности желудочного содержимого по Тепферу необходимы следующие реактивы:
- 0,5% спиртовой раствор диметиламидоазобензола: 0,5 г диметиламидоазобензола помещают в мерный 100-миллилитровый цилиндр и доливают до метки этиловым спиртом. Раствор наливают в капельницу.
- 1 % спиртовой раствор фенолфталеина: 1 г фенолфталеина помещают в мерный цилиндр на 100 мл и доливают до метки этиловым спиртом. Раствор переливают в капельницу.
- 0,1 N раствор едкого натра (приготовление см. в теме «Определение глюкозы в крови»).
- 1% раствор ализаринсульфоновокислого натрия: 1г реактива помещают в цилиндр на 100 мл и доливают дистиллированной водой до метки.
Техника определения. Определение кислотности желудочного содержимого по методу Тепфера ведут в двух отдельных порциях желудочного содержимого.
В первой порции определяют свободную соляную кислоту и общую кислотность, во второй — связанную соляную кислоту.
Титрование первой порции желудочного содержимого производят следующим образом. В первый химический стаканчик помещают 5 или 10 мл профильтрованного желудочного содержимого и сюда же приливают из капельницы 1-2 капли индикатора — 0,5% раствора диметиламидоазобензола. В присутствии свободной соляной кислоты желудочное содержимое окрашивается в красный цвет, если же ее нет, то оно окрашивается в оранжевый цвет. Устанавливают и записывают уровень 0,1 N раствора щелочи в бюретке. Затем титруют желудочное содержимое 0,1 N раствором щелочи до появления желтовато-красного окрашивания. Количество израсходованной на титрование щелочи записывают. Вслед за этим к желудочному содержимому приливают из капельницы 1-2 капли индикатора — 1 % раствора фенолфталеина. Цвет желудочного содержимого при этом не изменяется. Производят второе титрование до появления стойкого розового окрашивания. Отмечают количество щелочи, израсходованной на титрование. Эту цифру записывают. По первой цифре титрования рассчитывают свободную соляную кислоту, а по второй — общую кислотность.
Индикатор диметиламидоазобензол реагирует только в присутствии свободной соляной кислоты и окрашивает желудочное содержимое в красный цвет; в момент полной нейтрализации свободной соляной кислоты щелочью индикатор изменяет окраску и желудочное содержимое окрашивается в желтовато-красный цвет. Этот момент соответствует окончанию первого титрования. Индикатор фенолфталеин, добавляемый после окончания первого титрования, не изменяет окраски желудочного содержимого, так как реагирует в момент перехода кислой реакции в щелочную. Фенолфталеин придает желудочному содержимому розовый оттенок в момент полной нейтрализации всех кислореагирующих веществ. Изменение окраски свидетельствует об окончании второго титрования.
Пример расчета. Взято 5 мл желудочного содержимого. Уровень 0,1 N раствора щелочи установлен на деление «0». На первое титрование израсходовано 1 мл 0,1 N раствора щелочи, на второе титрование — 2 мл. На 100 мл желудочного содержимого израсходовано 0,1 N раствора щелочи в 20 раз больше: первое титрование 1X20 = 20 мл 0,1 N раствора щелочи, второе титрование 2X 20 = 40 мл 0,1 N раствора щелочи.
Ответ: свободная соляная кислота — 20, общая кислотность — 40.
При титровании 10 мл желудочного содержимого получающиеся цифры умножают на 10.
Если исходный уровень 0,1 N раствора щелочи находится не на «0», то при расчетах из каждой цифры титрования вычитают цифру исходного уровня, записанную до титрования. Количество свободной соляной кислоты часто высчитывают в процентах. С этой целью количество израсходованного на первое титрование 0,1 N раствора щелочи умножают на 0,00365 (1 мл 0,1 N раствора щелочи нейтрализует 0,00365 г свободной соляной кислоты). Чтобы не производить расчеты, пользуются таблицей (табл. 3).
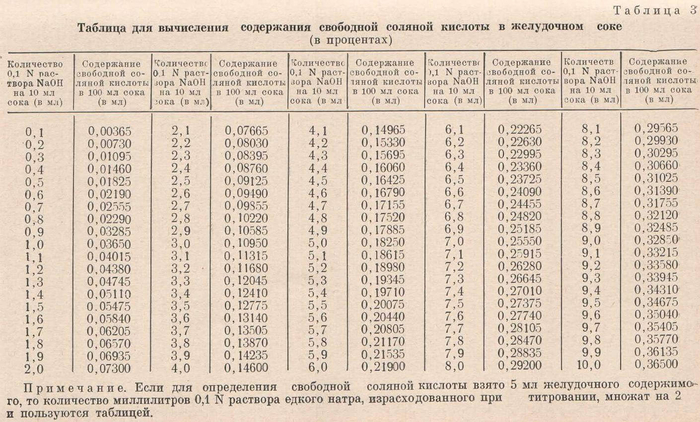
В норме свободная соляная кислота составляет 0,09— 0,16%. Об отсутствии свободной соляной кислоты в желудочном содержимом судят по появлению оранжевой окраски при добавлении 0,5% раствора диметиламидоазобензола. В этом случае к желудочному содержимому прибавляют 1-2 капли 1% раствора фенолфталеина и титруют до появления стойкого розового окрашивания.
Пример расчета. Для титрования взято 5 мл исследуемого желудочного содержимого. Исходный уровень 0,1 N раствора щелочи в бюретке у деления «0». Титрование заканчивается в момент появления стойкого розового окрашивания желудочного содержимого, уровень 0,1 N раствора щелочи в бюретке у деления шкалы 0,5. 0,5 X 20 = 10 мл 0,1 N раствора щелочи.
Ответ: свободная соляная кислота — 0, общая кислотность — 10.
Вторую порцию желудочного содержимого используют для определения связанной соляной кислоты.
Методы исследования кислотности желудка
Исследование кислотности выполняется при диагностике и лечении гастроэзофагеальной рефлюксной болезни, пищевода Барретта, язвы желудка, язвы двенадцатиперстной кишки, хронического гастрита, дуоденита, диспепсии, при термических и химических ожогах пищевода.
Существуют четыре основных метода исследования кислотности желудочного сока.
- Наиболее простой — при помощи ионообменных смол («Ацидотест», «Гастротест» и др.) по степени окрашивания мочи. Метод имеет небольшую точность и, поэтому, малоинформативен. В последнее время применяется редко. Регистрация препарата «Ацидотест» в России аннулирована в 1990-х годах.
- Аспирационные методы. Наиболее распространён из них метод . Содержимое желудка отсасывается при помощи резиновой трубки, а затем исследуется в лаборатории. Этот метод имеет свои достоинства, но имеет и серьёзные недостатки. В процессе отсасывания содержимое желудка, полученное из разных функциональных зон, перемешивается. К тому же сам процесс отсасывания нарушает нормальную работу желудка, искажая результаты исследования.
- Метод окрашивания стенки желудка при помощи орошения её специальным красителем через канал эндоскопа во время проведения гастроскопии. Этот метод также не может обеспечить требуемую точность, визуальное определение кислотности по изменению цвета красителя дает очень приблизительные результаты.
Исследование кислотности желудочного сока с помощью .
Электрометрический метод измерения кислотности непосредственно в желудочно-кишечном тракте — внутрижелудочная pH-метрия. Это наиболее информативный и физиологичный метод. Позволяет с помощью специальных приборов — ацидогастрометров, оснащённых pH-зондами с несколькими датчиками pH, измерять кислотность одновременно в разных зонах желудочно-кишечного тракта в течение длительного времени (до 24-х часов и более). Недостатком метода является невозможность измерения общего объёма кислотопродукции желудка.
Лабораторное определение кислотности желудочного сока
В лаборатории кислотность желудочного сока определяют титрованием его раствором едкого натра (NaOH) с участием различных химических индикаторов, меняющих свой цвет в зависимости от кислотности среды. Разделяют понятия общей кислотности желудочного сока, свободной и связанной кислотности.
Кислотность желудочного сока выражают или в титрационных единицах (количестве мл 0,01 М раствора едкого натра, необходимого для нейтрализации кислоты в 100 мл желудочного сока) или в ммоль HCl на 1 л желудочного сока. Численно эти значения совпадают. Обычно при титровании используют 5 мл желудочного сока. Поэтому, после титрования, нейтрализующее количество NaOH умножают на 20.
Соляная кислота в желудочной жидкости
В человеческом организме существуют особые клетки — париетальные, вырабатывающие HCl.
Они образуются с помощью желудочных желез. А те, в свою очередь, располагаются в районе тела и дна органа. Скопление секретированного такими микроорганизмами сока поддерживается постоянно. Его уровень равняется 160 ммоль/л. Однако степень субацидности желудочного раствора может изменяться за счет переменного значения париетальных организмов.
В организме здорового человекa присутствуют и другие виды подобных соединений, однако их количество незначительно. К примеру, молочная кислота, которая является продуктом жизнедеятельности молочнокислых микроорганизмов, таких как энтерококки, лактобактерии или лактококк лактис. Отсутствие HCl — единственная возможность выживания для них. Содержание молочной кислоты в органах ЖКТ указывает на то, что секреция недостаточная. В большинстве случаев этот элемент отслеживается в содержании желудочного сока при онкологии желудка.

Чтобы правильно оценить нормальное состояние пищеварительной системы, замеры необходимо производить одновременно в различных отделах пищевода или в разных локациях желудка, в 12-типерстной кишке. При обследовании необходимо отследить, как бактерии вырабатывают HCl и как она изменяется во времени, ее динамику — реакцию на употребление провоцирующих лекарств и стимуляторов.
Какие выполняет функции?
HCl — основной элемент желудочного сока, с ее помощью переваривается пища.
При недостаточной секреции такая функция становится невозможной, т. е. поступление питательных веществ в кровь нарушится и потребуется восстановление благоприятной среды. Кроме этого, HCl играет антисептическую и бактерицидную роль в пищеводе. В том случае, когда HCl в желудке мало, его защита под угрозой.
Как вырабатывается и нейтрализуется?
Как уже говорилось, HCl в желудочном соке производится специальными клетками — они находятся в верхней и средней части желудка. При норме вещества 1600 ммоль/л, отклонения в их работе дают возможность выявить симптомы, которые появляются в тех случаях, когда не происходит секреция. Нижний отдел желудка вырабатывает слизь, которая препятствует повреждению желудочных стенок. Кроме того, этот отдел вырабатывает гидрохлориды, благодаря которым появляется щелочь в желудке, так как он является последней «инстанцией» до проникновения пищи в кишечник. Слаженность работы способствует восстановлению нормального кислотного показателя.
Причины повышенной кислотности желудка
Избыточную секрецию соляной кислоты могут вызывать как экзогенные, так и эндогенные причины.
Часто повышенная кислотность желудка бывает спровоцирована неправильным питанием.
Слишком частое употребление в пищу острых, жирных и жареных блюд, кофе, черного чая, сладких газированных напитков может стать причиной избыточной продукции соляной кислоты. Выраженное раздражающее действие на стенку желудка оказывают алкогольсодержащие напитки. Важен не только качественный и количественный состав употребляемой пищи, но и режим питания. Большие порции блюд и тяжелая пища перед сном стимулируют избыточную продукцию соляной кислоты. Длительные перерывы между приемами пищи, более чем 8 часов, являются факторами, которые способствуют нарушению секреции желудочного сока и соляной кислоты.
Одной из основных причин нарушения секреции соляной кислоты является наследственная предрасположенность и наличие в желудке хеликобактерной инфекции. Это является первопричиной развития гастрита с повышенной кислотностью. Самое интересное, что бактерия хеликобактер пилори не поддается разрушительному действию со стороны соляной кислоты, и потому может свободно функционировать в желудочно-кишечном тракте. Заражение бактерией происходит посредством фекально-орального механизма. Существуют представления о возможной наследственной предрасположенности к данному заболеванию. Основной вред, который наносит эта бактерия — повреждение слизистой желудка за счет продуцируемых ею ферментов и токсинов. В результате этого процесса могут развиваться эрозии, язвы и их осложнения. Сами ферменты, выделяемые бактерией, нейтрализуют действие соляной кислоты и тем самым еще больше стимулируют ее продукцию и в последующем развитие воспаления слизистой стенки желудка.
Причины повышения кислотности желудка включают употребления некоторых групп лекарственных препаратов, которые прямо или опосредованно стимулируют секрецию соляной кислоты, способствуя развитию гастрита, язвенной болезни и других заболевани желудка. Одной из таких групп медикаментов являются нестероидные противовоспалительные лекарственные препараты. Наиболее неблагоприятные среди них в отношения побочного действия на слизистую желудка являются неселективные ингибиторы фермента циклооксигеназы-1. Самым ярким и известным большинству людей представителем данной группы препаратов является ацетилсалициловая кислота или аспирин. В настоящее время для предупреждения неблагоприятного влияния ацетилсалициловой кислоты, ее выпускают в специальной кишечнорастворимой форме, которая не оказывает раздражающего действия на слизистую желудка.
Глюкокортикостероидные препараты, применяемые главным образом для лечения заболеваний с аутоиммунной этиологией, также являются стимуляторами желудочной секреции и повышают кислотность желудка.
Часто обострение гастритов и язвенной болезни совпадают со стрессовыми ситуациями жизни.
Как понизить концентрацию аммиака/аммония в аквариуме?
 Молекула аммиака
Молекула аммиака
Ниже способы выведения аммиака и аммония из аквариума, их можно применять вместе и по отдельности.
СПОСОБ 1: Ежедневная смена воды по 10%. Этот способ наиболее актуален при запуске аквариума, когда к 1-2 недели NH3/NH4 могут свирепствовать.
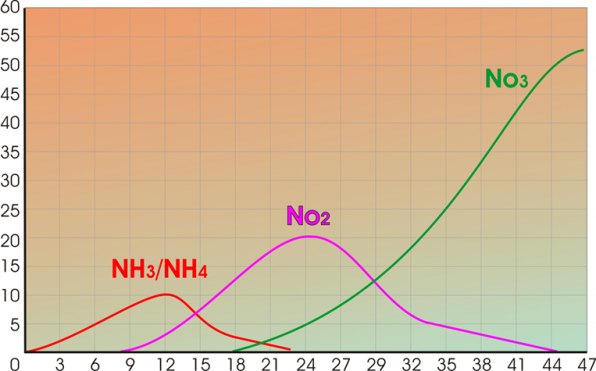 График становления азотного цикла в аквариуме после запуска
График становления азотного цикла в аквариуме после запуска
Если вы видите, что есть серьезные отклонения от графика. Действуйте указанным способом. Подменивая немного воды, вы снижаете концентрацию ядов, но в тоже время не сбиваете настройку азотного цикла в молодом аквариуме.
Обратим ваше внимание, что при аммиачной вспышке нельзя делать глубокие подмены воды (не слушаете всяких блаженных из Инета). Во-первых, вы можете сбить биологическое равновесие и азотный цикл
А во-вторых, крайне не рекомендуется резко выводить рыбок из занитрифицированного состояния. От этого они тоже могут уйти в страну вечного и вкусного мотыля.
СПОСОБ 2: Применение цеолита. Подробно о цеолите написано в нашей статье – здесь. Суть в двух словах, цеолит – ионообменник, который забирает на себя катионы NH3+|NH4+. Отметим, что цеолит действует плавно и в этом его достоинство, он мягонько так «всасывает аммиак», не нарушая дальнейшее течение дел в аквариуме.


СПОСОБ 3: Применение препаратов – блокаторов аммиака/аммония. Например, Sera toxivec. Такие препараты именно блокируют, а не удаляют из воды азотистые, они просто переводят их в безопасную для гидробионтов форуму, грубо говоря, препарат дает шанс рыбам не отравиться до тех пор, пока аквариумист наладит биобаланс: подменами воды, усилением фильтрации, аэрации, рассадкой рыбы и т.д.
В тоже время азотный цикл на то и цикл, выпадение одного звена влечет за собой сбой во всей цепочке. Мы рекомендуем использовать подобные препараты аккуратно, ну и когда в аквариум просто полный треш по аммиаку и нитриту.
СПОСОБ 4: Снижение температуры и кислотности воды. Это даже не способ, а метода, но проговорить его стоит. Аммиак более «забористый» в теплой и щелочной воде. Поэтому, если вы снизите температуру с 27 до 22 градусов – это уже облегчит жизнь гидробионтам. Тоже самое и с pH, желательно, чтобы среда в аквариуме была с pH 7 и ниже.
СПОСОБ 5: Аквариумный уголь. Сам по себе уголь не забирает на себя аммиак и аммоний. Но он адсорбирует «мертвую органику», которая является первоисточником возникновения NH3/NH4.
СПОСОБ 6: Применение стартовых препаратов. Стереотипно эти препараты почему-то называют «аквариумной химией». Самое смешное, что 99% подобных препаратов – это чистая биология. Химия – это Sera toxivec. Стартовые же препараты – это концентраты полезных бактерий нитрификаторов, которые расщепляют азотистые и/или способствуют развитию этих полезных колоний бактерий.

К таким препаратам можно отнести, например, Tetra SafeStart, Tetra FilterActive, Tetra Bacrozym и т.д.
Проблему этих препаратов, по отношению к аммиачной вспышке, можно выразить фразой: «хороша ложка к обеду» или «поздно пить боржоми, когда почки отказали». Свое отношение к стартовым препаратам мы подробно изложили в статье «Быстрый запуск аквариума». Здесь скажем, только то, что если у вас уже случился полный абзац с NH3/NH4, то поздно применять «стартовые» препараты» на «финише». Их применение имеет место быть при запуске аквариума, тогда они действительно сглаживают азотистые вспышки. То есть они не действуют здесь и сейчас – прямо вот сразу.
Вот такие способы удаления аммиака и аммония из аквариума мы расписали для вас. Наиболее эффективная схема на наш взгляд – совокупность способа 1, 2 и 5. В этом случае, мы достаточно быстро и мягко уберем яды.
Помните, что важную роль в становлении и удержании азотного цикла играет качественная фильтрация и аэрация аквариума. А также хороший грунт (легкий, пористы, покаты) уложенный слоем в 5-7 см. Ведь именно в грунте протекает львиная доля всех процессов нитрификации.
Подписывайтесь на нашYouTube-канал, чтобы ничего не пропустить
Категория: Аквариумные статьи / Полезные советы по содержанию рыбок | Просмотров: 13 308 | Дата: 3-12-2019, 21:04 |
Рекомендуем так же почитать:
- — Видео-обзор фильтра LAGUNA 1408
- — Сомики коридорасы виды
- — Барбосы
- — Анциструс видео-обзор
- — Тернеция видео-обзор
Кислоты
Прежде чем рассмотреть способы понижения кислотности, важно понимать, о какой именно кислоте идет речь и какие кислоты бывают. Кислота, которую вырабатывает желудок человека, носит название «соляная»
Она способна расщеплять попадающую в желудок пищу, но при нормальной концентрации она не наносит никакого вреда стенкам желудка. Тем более что она превосходно нейтрализуется за счет состава желудочного сока
Кислота, которую вырабатывает желудок человека, носит название «соляная». Она способна расщеплять попадающую в желудок пищу, но при нормальной концентрации она не наносит никакого вреда стенкам желудка. Тем более что она превосходно нейтрализуется за счет состава желудочного сока.
Если человек употребляет большое количество белковой пищи, то и кислоты в его организме начинает продуцироваться больше. Со временем кислота продолжает вырабатываться в прежнем объеме, даже если человек сократил употребление белков или перестал есть их совсем. Желудку нужно время для того, чтобы перестроиться, а пока человек вынужден искать действенные и безопасные способы, чем нейтрализовать соляную кислоту.
Важно знать, что никаких других кислот в нашем желудке нет, а если они туда каким-либо образом попадают, это может повлечь за собой самые страшные последствия, вплоть до смерти человека. Поэтому советы по поводу того, чем нейтрализовать серную кислоту в желудке, не имеют никакого смысла
Серная кислота используется для осушения газов или в качестве добавки к удобрениям, в органах пищеварения ее нет и не должно быть.
То же самое касается намерений нейтрализовать ортофосфорную кислоту в желудке, которая не может там оказаться никаким образом, если только человек не решит добавить в свой обед средство от ржавчины. Поэтому, встречая в рецептах или на упаковках БАДов такую информацию, следует знать, что от таких средств нужно держаться подальше.
А вот уксусная кислота в виде водного раствора вполне может попасть в наш желудок извне и не принести никакого вреда при соблюдении разумной дозировки. Заправки для салатов или маринады для мяса часто делаются из столового уксуса. В чистом виде уксусная кислота смертельно опасна, но даже столовым уксусом можно сильно отравиться. В этом случае необходимо думать не о том, чем нейтрализовать уксусную кислоту, а быстро вызывать скорую помощь и самостоятельно промывать желудок, принять любое растительное масло или смесь из яиц и молока. Категорически запрещается давать пострадавшим соду.
Зоны продукции и нейтрализации кислоты в желудке
Желудочный этап переваривания пищи происходит с помощью ферментов, важнейшим из которых является пепсин, требующих обязательно кислой среды. Однако кислота в химусе (кашице), состоящем из частично переваренной пищи и желудочных соков, перед эвакуацией из желудка должна быть нейтрализована.
Желудок условно можно разделить на кислотообразующую (верхнюю) и кислото-нейтрализующую (нижнюю) зоны, разделённые интермедиарной зоной, то есть зоной перехода от слабокислых pH (6,0-4,0) к резкокислым (pH менее 3,0) и располагающейся между телом желудка и его антральным отделом.
Так как при исследовании кислотности желудка диагностически важной является информация о процессах кислотопродукции и кислотонейтрализации, то измерение кислотности желудка должно происходить не менее, чем в двух зонах: теле желудка и антруме.
Нейтрализация кислоты в желудке производится, в основном, за счёт ионов гидрокарбонатов (HCO3-), секретируемых поверхностными клетками слизистой оболочки.
Сода
Как устранить избыточную кислоту в желудке? Самый популярный способ — это использовать обыкновенную пищевую соду. Она нейтрализует кислоту, и этот факт понятен каждому, знакомому с законами химии. Ведь сода – щелочь, а она является антагонистом кислоты.
Таким образом, зная, что сода нейтрализует кислоту, многие люди регулярно употребляют ее при признаках изжоги или боли в желудке. Действительно, сода оказывает кратковременный эффект снижения кислотности. И если под рукой нет других средств, чтобы понизить кислотность, вполне можно воспользоваться раствором соды.
Но при этом важно знать о процессе внутри организма при приеме соды. Она действует как всасывающий кислоту антацид, поэтому сразу после ее приема количество кислоты действительно понижается
Но взаимодействие соды и кислоты становится катализатором выработки углекислого газа. Газ, в свою очередь, оказывает стимулирующее действие на клетки желудка, которые продуцируют кислоту, и количество кислоты снова повышается, причем ее становится больше, чем до употребления разведенной в воде соды.
Поэтому люди, убежденные, что сода нейтрализует кислоту и является лучшим способом лечения проблемы повышенной кислотности желудка, вынуждены постоянно прибегать к данному методу.
А это, в свою очередь, приводит к защелачиванию крови. Человек, столкнувшийся с этим явлением, знаком и со всем перечнем неприятных симптомов: потеря аппетита, боль в животе, тошнота и рвота, судороги в мышцах. Также большое количество соды, а следовательно, и натрия, который в ней содержится, приводит к повышению давления, проблемам с почками, отекам.

Самым безобидным последствием регулярного употребления соды является урчание в кишечнике и диарея.
Таким образом, хоть сода (щелочь) нейтрализует кислоту, чрезмерное употребление ее небезопасно и для здорового человека. А беременным и кормящим женщинам, людям с повышенным давлением и хроническими заболеваниями ЖКТ и вовсе строго противопоказано такое лечение. Поэтому необходимо искать иные способы того, чем нейтрализовать кислоту в организме.