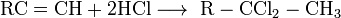Аммиак в аквариуме (опасно)! простыми словами о сложном! узнать!
Содержание:
- Химические
- Что мы узнали?
- Преимущества аммиачной воды
- Инструкция по применению аммиачной воды в качестве подкормки
- Применение
- Лечение отравлений:
- Некоторые химические свойства аммиака
- Аммиачная вода от вредителей
- Получение нитрида водорода
- Получение
- Физиологическое действие и токсикология
- Получение
- Как аммиак влияет на человеческий организм?
- Применение
- История
- Комплексообразование
- Степень опасности аммиака
- Аммиак в медицине
- Принцип действия водного аммиака
- Техника безопасности при работе с веществом
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
|
Взаимодействие |
Продукты реакции |
Уравнение |
|
С кислородом |
Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота |
– 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
|
С галогенами |
Азот, кислота |
2NH3 + 3Br2 → N2 + 6HBr |
|
С водой |
Гидроксид аммония или нашатырный спирт |
NH3 + H2O → NH4OH |
|
С кислотами |
Соли аммония |
– NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
|
С солями |
Замещает металл, образуя новую соль |
2NH3 + CuSO4 → (NH4)2SO4 + Cu |
|
С оксидами металлов |
Восстанавливает металл, образуется азот |
2NH3 + 3CuO → 3Cu + N2 + 3H2O |
Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Преимущества аммиачной воды
Разберем плюсы, и почему это средство получает такую популярность:
- Начнем с безопасности. Аммиачная вода имеет класс опасности IV по ГОСТу, это означает, что она является безопасным веществом для человека. Но нужно быть осторожным, пары аммиака плохо воздействуют на слизистые и кожу.
- Универсальность. Различные сельскохозяйственные растения хорошо реагируют на этот раствор.
- Внесение аммиачной воды в почву дает необходимое количество азота. Это прекрасно влияет на растения в период роста, что даст нужное количество урожая.
- Дешевизна по сравнению с другими удобрениями.
- Благодаря автоматизации, процесс не требует дополнительной человеческой силы.
Аммиачная вода имеет класс опасности IV по ГОСТу
Инструкция по применению аммиачной воды в качестве подкормки
Аммиачная вода — удобрение, используемое на огороде, без предварительной подготовки к применению. Дополнительное разведение раствора водой снижает результативность вещества. Разводят для подкормки растений 10-ти процентный аммиак.
Аммиачную воду в качестве удобрения рекомендуется использовать не постоянно, а эпизодически: в засушливые годы, при малоснежной зиме, при недостатке органических удобрений.
Обычно водный раствор аммиака применяют при осеннем внесении, после того как собран урожай, а почва оголилась. При этом должен быть соблюден температурный режим: среднесуточная температура не должна превышать +10 °С, дневная — + 13 °С, а ночная должна быть не ниже 0 °С. Чтобы избежать выделение азота в летучем виде, обработку проводят в вечернее время.
Исключение по регламенту внесения составляет подкормка аммиачной водой средних и тяжелых грунтов в условиях после малоснежной и ветреной зимы. В этом случае аммиачный раствор вносят весной, соблюдая тот же температурный режим. Посадка культур при этом возможна только через неделю после обработки. Чтобы культуры не сгорели, аммиачную воду не применяют под вегетирующими растениями.
Аммиачная вода для обычного полива не подходит. Ее необходимо вносить в почву на глубину от 10 до 15 см в зависимости от характеристики грунта. Поэтому раствор аммиака заглубляют культиватором или для обработки применяют метод фертигации. Правда, способ не обеспечивает равномерность внесения. Кроме этого, при теплой, солнечной погоде возможно испарение в воздух значительного количества аммиака. На дачном участке также используют опрыскиватель, оснащенный струйным распылителем.
Обработка водным раствором аммиака способствует закислению почвы, поэтому через неделю после использования аммиачной воды проводят известкование участка. Для этого вносят известковую муку, ее расход составляет 3-4 кг на ту же площадь, по которой было использовано 10-12 л аммиачного раствора.
Для каждой культуры предусмотрено определенное количество вещества, необходимое для жизнедеятельности. Превышение нормы может способствовать накоплению нитратов, а также губительно сказаться на почвенной микрофлоре и микрофауне.
| Культура | Регламент применения |
| Томаты и огурцы | 0,5-0,6 л вещества на сотку земли вносится перед посадкой |
| Пропашные | 0,4-0,5 л на сотку |
| Лук, чеснок | 0,6-0,7 л на сотку, подкармливают каждые 10 дней |
| Плодовые деревья и кустарники | 0,6-0,7 л на сотку, при увядании |
| Земляника | 0,5-0,6 л на сотку, трижды за сезон: сначала до вегетации, затем после вегетации, последний раз — после сбора ягод. |
Применение
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717) (см. Аммиачная холодильная установка).
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь
Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5—1 с). Внутрь (только в разведении) для индукции рвоты
При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипячёной воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения.
Аммиачная вода NH3⋅H2O{\displaystyle {\ce {NH3.H2O}}} — продукт, представляющий собой газообразный аммиак NH3{\displaystyle {\ce {NH3}}}, растворённый в воде.
Лечение отравлений:
При попадании брызг раствора аммиака в глаза немедленно обильное промывание широко раскрытого глаза водой или 0,5-1% раствором квасцов; вазелиновое или оливковое масло. При резких болях -1-2 капли 1% раствора новокаина или 1 капля 0,5% раствора дикаина с адреналином (1 : 1000). Надеть очки-консервы. В последующем применяют закапывание 0,1% раствора ZnSO4, 1% раствора НзВОз или 30% раствора альбуцида. При поражении кожи — обмывание чистой водой, наложение примочки из 5% раствора уксусной, лимонной, виннокаменной или соляной кислот. При отравлении NH3 через дыхательные пути — свежий воздух, вдыхание теплых водяных паров (лучше с добавлением уксуса или нескольких кристаллов лимонной кислоты), 10% раствора ментола в хлороформе. Пить теплое молоко с боржомом или содой. Кодеин (по 0,015 г) или дионин (по 0,01 г). При удушье — кислород (вдыхать до уменьшения одышки или цианоза); при спазме голосовой щели- тепло на область шеи, теплые водные ингаляции, атропин (подкожно 1 мл 0,1% раствора), при необходимости — трахеотомия. При нарушениях или остановке дыхания — искусственное дыхание. По показаниям — камфора, кофеин, кордиамин, коразол, успокаивающие средства (настойка валерьяны, бромиды).
Некоторые химические свойства аммиака
Нитрид водорода характеризуется довольно высокой химической активностью и способен вступать в реакции со многими веществами.
При взаимодействии аммиака с кислотами образуются соответствующие соли аммония. Так, к примеру, в результате реакции с азотной кислотой образуется аммиачная селитра:
NH3 + HNO3 → NH4NO3.
При взаимодействии с HCl образуется хлорид аммония:
NH3+ HCl → NH4Cl.

Соли аммония представляют собой твердые кристаллические вещества, разлагающиеся в воде и обладающие свойствами, присущими солям металлов. Растворы соединений, образованных в результате взаимодействия аммиака и сильных кислот, имеют слабокислую реакцию.
За счет атомов азота нитрид водорода является активным восстановителем. Восстановительные свойства его проявляются при нагревании. При горении в атмосфере кислорода он образует азот и воду. В присутствии катализаторов взаимодействие с кислородом дает оксид азота. Нитрид водорода имеет способность восстанавливать металлы из оксидов.
Галогены в результате реакции с аммиаком образуют галогениды азота – опасные взрывчатые вещества. При взаимодействии с карбоновыми кислотами и их производными нитрид водорода образует амиды. В реакциях с углем (при 1000 °С) и метаном он дает синильную кислоту.
С ионами металлов аммиак образует аминокомплексы, или аммиакаты (комплексные соединения), имеющие характерную особенность: атом азота всегда связан с тремя атомами водорода. В результате комплексообразования меняется окраска вещества. Так, к примеру, голубой раствор медного купороса при добавлении нитрида водорода приобретает интенсивный сине-фиолетовый цвет. Многие из аминокомплексов обладают достаточной устойчивостью. Благодаря этому они могут быть получены в твердом виде.

В жидком аммиаке хорошо растворяются как ионные, так и неполярные неорганические и органические соединения.
Аммиачная вода от вредителей
Поможет аммиачная вода и в борьбе с вредителями. Этот препарат раскисляет почву, благодаря чему отпугивает личинок майского жука, проволочника, слизней, предпочитающих кислую почву.
Если вашим культурам досаждает тля, разведите 50 мл препарата в ведре (10л) воды, добавив туда чайную ложку жидкого мыла для лучшего прилипания. Этим раствором опрыскивайте растения. Для тли это смертельно, а для растения будет дополнительной подкормкой.
Для профилактики от медведки, рекомендуется развести 10 мл аммиачной воды в десяти литрах воды обычной. При посадке капусты вливайте по пол-литра такого раствора в каждую лунку и медведка вас не потревожит.
Для отпугивания морковной и луковой мух сделайте раствор 5 мл препарата в 10 литрах воды. После поливайте посадки моркови и лука.
С помощью аммиачной воды так же можно бороться со скрытнохоботником. Надо развести 25 мл средства в 10 л воды. Этим раствором рекомендуют поливать раз в неделю грядки с луком и чесноком (они более всех подвержены этому вредителю).
Для профилактики от проволочника следует добавить 10 мл средства в 10 л воды. При высадке помидор и картофеля добавлять по пол-литра в каждую лунку.
Чтобы прогнать с участка слизней советуют развести 2 столовых ложки аммиачной воды в 1 л обычной воды. Этим раствором опрыскивать растения перед наступлением сумерек.
Аммиачная вода может с успехом применяться от мошки в комнатных растениях. Надо развести 25 мл средства в 2 л отстоянной воды и получившимся раствором поливать растения под корень.
Надеемся, наши простые советы относительно применения аммиачной воды в саду и огороде помогут вам. Пишите свои комментарии ниже. Удачи и больших урожаев!
Занимаясь собственным огородом, узнаешь и пробуешь множество средств от вредителей и удобрений. Делюсь проверенным практикой средством, использующимся одновременно для защиты будущего урожая и повышения плодородия. Дешево, но эффективно.
Поделюсь, как правильно применить аммиачную воду для огурцов, помидоров, как подкормить лук, чеснок обезопасить капусту от вредителей.
Получение нитрида водорода
Английский физик и химик Р. Бойль в опытах сжигал навоз и наблюдал образование белого дыма над палочкой, смоченной в соляной кислоте и внесенной в струю получившегося газа. В 1774 году другой британский химик Д. Пристли нагревал хлорид аммония с гашеной известью и выделил газообразное вещество. Пристли назвал соединение «щелочным воздухом», ведь его раствор проявлял свойства слабого основания. Получил объяснение опыт Бойля, в котором аммиак взаимодействовал с соляной кислотой. Твердый хлорид аммония белого цвета возникает при соприкосновении молекул реагирующих веществ прямо в воздухе.
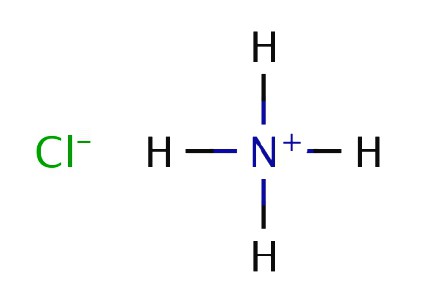
Химическая формула аммиака была установлена в 1875 году французом К. Бертолле, который провел эксперимент по разложению вещества на составные компоненты под действием электрического разряда. До сих пор опыты Пристли, Бойля и Бертолле воспроизводят в лабораториях для получения нитрида водорода и хлорида аммония. Промышленный способ разработал в 1901 А. Ле Шателье, получивший патент на метод синтеза вещества из азота и водорода.
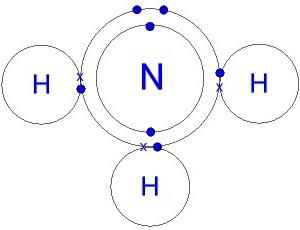
Получение
Нитрид титана можно получить одним из следующих способов.
Непосредственным насыщением титана азотом:
- Процесс азотирования проводят обычно при температуре выше 1100 °C в среде азота или диссоциированного аммиака. Для этой цели используют титан в виде порошка или стружки. Чистый порошок титана может быть заменён гидридом титана;
Взаимодействием тетрахлорида титана со смесью азота и водорода:
- В основе этого способа лежит реакция:
- 2TiCl4+2NH3⟶2TiN+6HCl+Cl2{\displaystyle {\ce {2TiCl4 + 2NH3 -> 2TiN + 6HCl + Cl2}}}
- которую проводят при температуре выше 1000 °C. Также образующийся нитрид титана можно осадить на вольфрамовую нить нагретую до температуры 1400—2000 °C;
Разложением аминохлоридов титана:
- TiCl4⋅4NH3⟶TiN+HCl+NH3{\displaystyle {\ce {TiCl4.4NH3 -> TiN + HCl + NH3}}}
- Аминохлорид титана разлагается с образованием промежуточного продукта TiNCl, нагрев которого до температуры 1000 °C приводит к образованию свободного от хлора нитрида титана;
Восстановлением оксида титана углеродом в среде азота:
- В основе процесса лежит реакция:
- 2TiO2+4C+N2⟶2TiN+4CO{\displaystyle {\ce {2TiO2 + 4C + N2 -> 2TiN + 4CO}}}
- С увеличение температуры процесса восстановления с 1000 °C до 1700 °C выход нитрида титана увеличивается, но при этом в продуктах реакции наблюдается появление карбида титана. Этот способ весьма пригоден для получения технически чистого нитрида титана в больших количествах, используемого для изготовления огнеупоров;
Синтезом в плазме:
- Как исходный продукт для получения нитрида титана может быть использован TiCl4 или порошок титана, который подают в струю плазмы генерируемую СВЧ-плазмотроном. Плазмообразующим газом является азот. Порошки полученные этим способом могут иметь размеры от 10 нм до 100 нм;
Самораспространяющимся высокотемпературным синтезом:
- Суть способа заключается в химической реакции титана с азотом, которая происходит с выделением тепла. Процесс ведут в герметическом реакторе, в котором процесс самопроизвольного горения инициируют нагревом контейнера заполненного азотом и порошком титана.
Физиологическое действие и токсикология
Аммиак NH3 (аммониак, нитрид водорода) относится к умеренно-токсичным химическим веществам, однако в больших концентрациях (как и другие пниктогеноводороды) он может стать сильным ядом для человека.
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация аммиака в воздухе рабочей зоны производственного помещения (ПДКр.з.) составляет 20 мг/м³. В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная концентрация аммиака (ПДКс.с.) не должна превышать 0,04 мг/м³. Максимальная разовая концентрация в атмосфере — 0,2 мг/м³. Таким образом, ощущение запаха аммиака свидетельствует о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Туркестанской (ранее — Южно-Казахстанской) области Казахстана.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
-
- N2+3H2⇄2NH3{\displaystyle {\mathsf {N_{2}+3H_{2}\rightleftarrows 2NH_{3}}}} + 91,84 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит, и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Выход аммиака (в объёмных процентах) в процессе Габера при различных температурах и давлении имеет следующие значения:
| 100 ат | 300 ат | 1000 ат | 1500 ат | 2000 ат | 3500 ат | |
|---|---|---|---|---|---|---|
| 400 °C | 25,12 | 47,00 | 79,82 | 88,54 | 93,07 | 97,73 |
| 450 °C | 16,43 | 35,82 | 69,69 | 84,07 | 89,83 | 97,18 |
| 500 °C | 10,61 | 26,44 | 57,47 | Нет данных | ||
| 550 °C | 6,82 | 19,13 | 41,16 |
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
-
- NH4Cl+NaOH→NH3↑+NaCl+H2O{\displaystyle {\mathsf {NH_{4}Cl+NaOH\rightarrow NH_{3}\uparrow +NaCl+H_{2}O}}}
Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашёной известью.
-
- 2NH4Cl+Ca(OH)2→CaCl2+2NH3↑+2H2O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}\uparrow +2H_{2}O}}}
Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление (при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер). В промышленности аммиак осушают в абсорбционных колоннах.
Расходные нормы на тонну аммиака
На производство одной тонны аммиака в России расходуется в среднем 1200 н.м³ природного газа, в Европе — 900 н.м³
.
Белорусский «Гродно Азот» расходует 1200 н.м³ природного газа на тонну аммиака, после модернизации ожидается снижение расхода до 876 н.м³.
Украинские производители потребляют от 750 н.м³ до 1170 н.м³ природного газа на тонну аммиака.
По технологии UHDE заявляется потребление 6,7 — 7,4 Гкал энергоресурсов на тонну аммиака.
Как аммиак влияет на человеческий организм?
Большинство людей контактируют с аммиаком, вдыхая его как газ или испарения. Поскольку аммиак существует в природе и имеется в моющих средствах, они могут быть его источниками.
Широкое использование аммиака в сельскохозяйственных и промышленных районах также означает, что повышение его концентрации в воздухе может произойти во время случайных выбросов или преднамеренных терактов.
Безводный газообразный аммиак легче воздуха и поэтому высоко поднимается, поэтому в целом он рассеивается и не накапливается в низинах. Однако при наличии сырости (повышенная относительная влажность) сжиженный безводный аммиак формирует испарения тяжелее воздуха. Эти пары могут разноситься над поверхностью земли или над низинами.
Как действует аммиак?
Аммиак начинает взаимодействовать сразу после контакта с влагой на поверхности кожи, глаз, рта, дыхательных путей и частично слизистых поверхностей и формирует очень едкий гидроксид аммония. Гидроксид аммония вызывает некроз тканей из-за нарушения клеточных мембран, ведет к разрушению клеток. Как только протеин и клетки распадаются, вода извлекается в результате воспалительной реакции, что приводит к дальнейшему повреждению.
Применение
Купол Соборного храма во имя Богоявления Господня Ниловой пустыни, покрытый нитридом титана.
Применяется как жаропрочный материал, в частности из него делают тигли для плавки металлов в бескислородной атмосфере.
В металлургии это соединение встречается в виде относительно крупных (единицы и десятки микрон) неметаллических включений в сталях, легированных титаном. Такие включения имеют на шлифах, как правило, форму квадратов и прямоугольников, их легко идентифицировать методом металлографического анализа. Такие крупные частицы нитрида титана, образующиеся из расплава, приводят к ухудшению качества литого металла.
Нитрид титана используется для создания износостойких покрытий металлорежущего инструмента, также для зубных протезов жёлтого «под золото» цвета.
Используется в микроэлектронике в качестве диффузионного барьера совместно с медной металлизацией и др.
Также нитрид титана применяется в качестве износостойкого и декоративного покрытия. Изделия, покрытые им, по внешнему виду похожи на золото и могут иметь различные оттенки, в зависимости от соотношения металла и азота в соединении. Нанесение покрытия из нитрида титана производится в специальных камерах термодиффузионным методом. При высокой температуре титан и азот реагируют вблизи поверхности покрываемого изделия и диффундируют в саму структуру металла.
Соединение не используется для покрытия электрических контактов.
История
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода. Аммиак был очень нужен для синтеза соединений азота, поскольку получение их из чилийской селитры ограничивалось постепенным истощением запасов последней. Проблема уменьшения запасов селитры обострилась к концу XIX века. Только в начале XX века удалось изобрести процесс синтеза аммиака, пригодный для промышленности. Это осуществил Ф. Габер, начавший трудиться над этой задачей в 1904 году и к 1909 году создавший небольшой контактный аппарат, в котором использовал повышенное давление (в соответствии с принципом Ле-Шателье) и катализатор из осмия. 2 июля 1909 года Габер устроил испытания аппарата в присутствии К. Боша и А. Митташа, оба — от Баденского анилинового и содового завода (BASF), и получил аммиак. К. Бош к 1911 году создал крупномасштабную версию аппарата для BASF, а затем был построен и 9 сентября 1913 года вступил в строй первый в мире завод по синтезу аммиака, который был расположен в Оппау (ныне район в черте города Людвигсхафен-на-Рейне) и принадлежал BASF. В 1918 году Ф. Габер стал лауреатом Нобелевской премии по химии «за синтез аммиака из составляющих его элементов». В России и СССР первая партия синтетического аммиака была получена в 1928 году на Чернореченском химическом комбинате.
Комплексообразование
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
-
- CuSO4+4NH3⟶Cu(NH3)4SO4{\displaystyle {\ce {CuSO4 + 4NH3 -> SO4}}}.
- Ni(NO3)2+6NH3⟶Ni(NH3)6(NO3)2{\displaystyle {\ce {Ni(NO3)2 + 6NH3 -> (NO3)2}}}.
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4{\displaystyle {\ce {CuSO4}}}) переходит в тёмно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2{\displaystyle {\ce {Ni(NO3)2}}}) в сине-фиолетовую. Наиболее прочные комплексы с NH3{\displaystyle {\ce {NH3}}} образуют хром и кобальт в степени окисления +3.
Степень опасности аммиака
Аммиак по степени воздействия на организм относится к малоопасным веществам — 4 класс опасности. При ингаляционном воздействии относится к высокотоксичным веществам.
Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Смесь аммиака с воздухом взрывоопасна при содержании в ней от 15 до 28 % (об.) аммиака. Воспламеняется от искр и пламени.
Оборудование для производства сжиженного безводного аммиака должно быть герметично, иметь взрывозащищенное исполнение
При работе с жидким аммиаком необходимо соблюдать правила предосторожности, использовать средствами индивидуальной защиты. Все помещения должны быть оснащены приточно-вытяжной вентиляцией
Необходимо проводить систематический контроль содержания аммиака в воздухе рабочей зоны.
Аммиак является загрязнителем атмосферного воздуха. Превышение предельно допустимых концентраций аммиака в воде водоема может привести к гибели его обитателей. При попадании аммиака в воду, появляется запах нашатырного спирта. Не допускается попадание аммиака в грунтовые воды. Удаление атмосферных вод с участков склада, где может пролиться аммиак, а также других сточных вод, загрязненных аммиаком, должно проводиться через контрольно-накопительные емкости с выпуском из них в зависимости от результатов анализа воды.
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт.
Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания.
Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов.
При случайном поражении аммиаком слизистой оболочки глаза, промыть глаза водой (по 15 раз через каждые 10 мин) или 5 % раствором борной кислоты, не растирая глаза. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приёма внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка.
Взаимодействие с другими лекарственными средствами неизвестно.
Принцип действия водного аммиака
Водный раствор аммиака в земле превращается в соли азотной кислоты или, проще говоря, нитраты. Растение, в свою очередь, превращает их в аминокислоты – блоки, из которых строятся белки необходимые вам с нами. Нитраты находятся в почве повсюду, после продуктов жизнедеятельности животных, растений и микроорганизмов. Но стоит бояться не нитратов, а их переизбытка. Для каждого растения есть свое количество, которое необходимо для правильного функционирования.
Аммиачная вода 0,5л
Главным показателем к применению аммиачной воды будет являться неудобренная истощенная земля. Выращивание на участке земли одних и тех же культур может забрать все минералы, после чего на восстановление уйдут годы. Севооборот может замедлить процесс истощения, но это не является панацеей. Циклично удобряя почву можно добиться хорошего результата в выращивании культур. Использованием аммиака водного мы улучшаем рост и качество зерновых, свеклы, моркови капусты и других полезных культур.
Техника безопасности при работе с веществом
Сам по себе водный раствор аммиака является негорючей и невзрывоопасной жидкостью, но при выделении паров аммиака в помещениях могут скапливаться взрывоопасные концентрации. Даже в малых концентрациях они вызывают следующие негативные реакции со стороны организма человека:
- обильное слезотечение;
- сильный кашель;
- удушье;
- ринит;
- головокружение;
- разъедание желудочно-кишечного тракта при проглатывании;
- ожог слизистых оболочек;
- отек легких при накоплении в них паров (в результате длительного вдыхания в течение 48 часов), что в конечном итоге может привести к смерти.
Поэтому при работе с этим веществом соблюдают следующие меры предосторожности:
- использование вытяжного шкафа;
- герметизация технологического оборудования и тары;
- использование средств индивидуальной защиты: резиновых перчаток, спецодежды, противогазов и защитных очков.
Это соединение является также токсичным для флоры и фауны водоемов.