История открытия бензола
Содержание:
Каменноугольное сырье
В металлургии при использовании каменного угля, а если уточнить — его сухой перегонки, получают кокс. Во время этой процедуры ограничивается поступление воздуха. Не стоит забывать и то, что до температуры 1200-1500 по Цельсию нагревается уголь.
Углехимический бензол нуждается в доскональном очищении. Нужно избавиться в обязательном порядке от метила циклогексана и его товарища н-гептана. Насыщенные углеводороды тоже должны быть изъяты. Бензолу предстоит процесс разделения, очищения, который будет осуществляться не один раз.
Метод, описанный выше, самый старый, но по истечении времени он теряет свои высокие позиции.
Примечания
- ↑ Introduction to Chemical Engineering Thermodynamics (англ.) // J. Chem. Educ.
- ↑
- ↑
- Helmut Fiege, P.J. Garratt, Christ. J. Grundmann, Gundermann, Wolfgang Loeser, Peter Müller, Heidi Müller-Dolezal, Peter L. Pauson, Renate Stoltz, Hanna Söll, M. Zander Houben-Weyl Methods of Organic Chemistry Vol. V/2b, 4th Edition: Arenes and Arynes, Издание четвёртое, Georg Thieme Verlag, 2014, ISBN 3131799749, 9783131799746
- Kasper, Dennis L.et al. (2004) Harrison’s Principles of Internal Medicine, 16th ed., McGraw-Hill Professional, p. 618, ISBN 0071402357.
- Розенцвит Г. Э. Клиника профессиональных нейротоксикозов. Л,, 1964, 18 с.
- Кушелев В. П., Орлов Г. Г., Сорокин Ю. Г. Охрана труда в нефтеперерабатывающей и нефтехимической промышленности. — М.: Химия, 1983. — С. 42. — 472 с.
Температура — кипение — бензол
Процесс заключается в том, что реакционную массу нагревают примерно до температуры кипения бензола ( 76 — 83 С); бензол подают на хлорирование в избытке. При такой температуре часть образующегося хлорбензола испаряется. На испарение расходуется значительное количество выделяющегося при реакции тепла; остальное интенсивно отводят, благодаря чему хлораторы, работающие при кипении реакционной массы, имеют высокую производительность. В качестве катализатора применяют хлорид железа в количестве 0 01 — 0 015 % ( масс.) от бензола. Чтобы избежать образования полихлоридов, хлорирование проводят не до конца, а оставляют 50 — 68 % непревращенного бензола. В этом случае полихлоридов образуется не более чем 3 5 — 4 5 % от количества хлорбензола.
Процесс заключается в том, что реакционную массу нагревают примерно до температуры кипения бензола ( 76 — 83 С); бензол подают на хлорирование в избытке.
Бензол представляет собой бесцветную жидкость с характерным запахом, нерастворимую в воде; температура кипения бензола 80 С, температура замерзания 5 5 С.
Чтобы смесь закипела, ее нужно нагреть до более высокой температуры, промежуточной между температурами кипения бензола и толуола и тем более близкой к температуре кипения толуола ( 110 6), чем больше находится его в смеси.
Коксохимический бензол по составу насыщенных примесей и значительной доли углеводородов, кипящих при температуре выше температуры кипения бензола, является несколько — необычным сырьем.
Алкилбензолы кипят немного выше соответствующих соединений ряда циклогсксана, хотя температура кипения самого циклогексана немного выше температуры кипения бензола.
Процесс получения хлорбензола, применяемый в СССРазй, заключается в том, что реакционная масса разогревается до температуры кипения бензола ( 76 — 8.3 С); при этом часть бензола, подаваемою ня хлорирование в избытка, и некоторое количество образующегося хлорбензола испаряются.
Указанная погоноразделительная способность колонки вполне достаточна для четкого разделения алкилбензолов при ректификации, так как имеющаяся разность температур кипения бензола, моно -, ди — и триизопропилбензола достигает 20 и более.
В результате образуются термически устойчивые алкилтиофены, которые обладают температурой кипения, на 60 — 70 град превышающей температуру кипения бензола.
Таким образом, произвольность назначения в качестве степени свободы температуры двухкомпонентной двухфазной системы бензол — толуол ограничена интервалом от температуры кипения бензола до температуры кипения толуола.
Сделанное Андерсоном открытие, что характерные примеси, содержащиеся в бензоле, кипят на 17 — 20 С выше температуры кипения бензола, было оценено как исключительное и скорее случайное явление, несмотря на то, что еще в 1930 г. была опубликована схема , в соответствии с которой все примеси, образующие тангенциальные или почти тангенциальные изобары температур кипения, перегоняются вместе с основным из рассматриваемых компонентов при температуре, почти равной температуре кипения основного-компонента.
В описанном Андерсоном случае бензол следует рассматривать как основной компонент, а примеси — как вещества, образующие изобары касательные или почти касательные к горизонтальной линии, проведенной через точку, характеризующую температуру кипения бензола.
Смесь 4 г ( 0 037 моля) 1-амино — 2 — Цианоциклопентена, 3 8 г ( 0 039 моля) циклогексанона, 40 г полифосфорной кислоты н 40 мл сухого бензола перемешивают 3 ч при температуре кипения бензола. После охлаждения реакционную массу разбавляют SO мл воды и экстрагируют эфиром. Водный слой нейтрализуют раствором аммиака до рН 7 0 и фильтруют. Выделившийся осадок отфильтровывают, промывают водой.
|
Зависимость между пар — Пример графического расчета. |
Температура совместного кипения ( трехфазная точка кипения) определена точкой D, как пересечение линии постоянного внешнего давления ( 760 мм рт. ст.) и суммы парциальных давлений насыщенных паров веществ. Температура кипения бензола определяется точкой Л, А ежду точками А и D находятся точки, которые определяют температуру дистилляции бензола с перегретым водяным паром. Если во время процесса в паровой фазе сохраняется насыщенность парами бензола, то с повышением перегрева водяного пара все время уменьшается его парциальное давление в паровой фазе, а при понижении температуры от / А до / AZ парциальное давление водяного пара увеличивается.
Гомологический ряд
Бензол образует гомологический ряд аренов с общей формулой CnH2n-6.
Названия гомологов формируются с помощью суффикса «-ол». Также используются тривиальные названия:
- бензол – С6Н6;
- метилбензол (толуол) – C7H8;
- этилбензол – C8H10;
- пропилбензол – C9H12;
- бутилбензол (дурол) – C10H14.
Рис. 2. Структурные формулы гомологов бензола.
Для гомологов характерна структурная изомерия по углеродному скелету радикала и по положению заместителей в бензольном кольце. Чем длиннее радикал, тем больше изомеров он образует. Заместители могут располагаться друг напротив друга (пара-вещества), у соседних атомов углерода в бензольном кольце (орто-вещества) или через один атом (мета-вещества).
Рис. 3. Возможное размещение заместителей в бензольном кольце.
К бензолу могут присоединяться как предельные, так и непредельные углеводороды. Однако во втором случае образованные вещества не являются гомологами бензола, так как не соответствуют формуле.
Применение
Бензол, физические свойства которого указаны выше, служит сырьем для органического синтеза в промышленных целях. Две трети добытого вещества идут на производство таких соединений, как циклогексан, кумол. Ранее бензол применялся в уличных фонарях.
Огромное количество вещества расходуется на получение нитробензола, который впоследствии восстанавливается в анилин. Технически эта реакция проходит следующим образом:

- Происходит воздействие соляной кислоты на бензол. Необходимо присутствие железа.
- Оно реагирует на кислоту, в результате чего возникают атомы водорода, собственно, он и влияет на образование анилина.
Он используется для того, чтобы синтезировать как различные красители, так и лекарства.
Бензол расходуется для получения фенола. Из него производят фенолформальдегидные смолы. Такое вещество, как гексахлорциклогексан, получило большое распространение в качестве средства для борьбы с насекомыми и вредителями. Оно широко используется в сельском хозяйстве.
Бензол (химические и физические свойства кратко описаны в данной статье) входит в состав такого топлива, как бензин. Поскольку вещество очень токсично, его содержание не превышает пяти процентов.
Ряд бензола
Формула бензола – С6Н6. Это бесцветная жидкость со сладковатым запахом. Бензол входит в состав бензина и используется для изготовления лекарств, пластмасс, искусственного каучука, красителей. Является токсичным веществом.
Основа молекулы бензола – бензольное кольцо, которое образуют шесть атомов углерода, соединённых σ-связями. К каждому атому углерода присоединён посредством простой связи водород. Прочную связь между атомами углерода обозначают кругом внутри шестиугольника.
Рис. 1. Структурная формула бензола
Гомологи отличаются друг от друга одной группой -СН2. Общая молекулярная формула гомологов бензола – CnH2n-6. Наименования гомологов соответствуют наименованиям алканов с суффиксом «-ил» и словом «бензол». Также широко используются тривиальные названия с суффиксом «-ол».
Примеры нескольких представителей ряда бензола описаны в таблице.
|
Гомолог |
Формула |
Физические свойства |
|
Метилбензол (толуол) |
C7H8 |
Бесцветная горючая жидкость, проявляющая слабое наркотическое действие. Смешивает с углеводородами, спиртами, эфирами в неограниченном количестве, но не смешивается с водой |
|
Этилбензол |
C8H10 |
Бесцветная токсичная жидкость с запахом бензина. Растворяется в спирте, бензоле, эфире, CCl4 |
|
Пропилбензол |
C9H12 |
Бесцветная горючая жидкость с резким запахом. Хорошо смешивается с органическими растворителями, не растворим в воде |
|
Бутилбензол (дурол) |
C10H14 |
Бесцветное летучее кристаллическое вещество с запахом камфоры. Плохо растворяется в уксусной кислоте, легко растворяется в бензоле, эфире, спирте |
К бензольному кольцу могут присоединяться не только предельные углеводородные радикалы. Например, стирол или винилбензол состоит из бензольного кольца, к которому присоединён ненасыщенный углеводородный радикал -СН=СН2. Наличие бензольного кольца указывает, что стирол – ароматический углеводород. Однако из-за наличия двойной связи и несоответствия формуле CnH2n-6 стирол нельзя отнести к гомологическому ряду бензола.
Рис. 2. Структурная формула стирола
Бензол впервые выделил Майкл Фарадей в 1825 году из коксового (светильного) газа, представляющего собой смесь метана, водорода и угарного газа.
Метод получения 1.
органической химииОрганический синтез
В круглодонную колбу наливают 11 мл концентрированной азотной кислоты. При взбалтывании и наружном охлаждении холодной водой медленно добавляют 13 мл концентрированной серной кислоты. После охлаждения нитрующей смеси до комнатной температуры постепенно, по 1 мл вводят при непрерывном взбалтывании 10 мл бензола. Закончив приливание бензола, колбу закрывают пробкой с воздушным холодильником и содержимое нагревают на водяной бане 30 мин при 60°С (температура воды в бане), часто взбалтывая реакционную смесь и строго выдерживая температуру реакции.
После завершения процесса колбу охлаждают водой до комнатной температуры и ее содержимое переливают в делительную воронку. Нижний (кислотный) слой сливают, а верхний (ннтробензол) промывают последовательно водой, 5%-ным раствором гидроксида натрия (для нейтрализации остатка кислот) и снова водой. При проведении этих операций нитробензол будет находиться в нижнем слое. После промывания нитробензол сливают в сухую колбу и добавляют прокаленный хлорид кальция. Колбу закрывают пробкой с воздушным холодильником и нагревают на кипящей водяной бане до тех пор, пока жидкость не станет прозрачной. Затем ее переливают в колбу Вюрца (без хлорида кальция) и перегоняют с воздушным холодильником, собирая фракцию, кипящую при 207- 211°С. Нитробензол нельзя перегонять досуха во избежание разложения со взрывом побочного продукта реакции — м-динитробензола.
Выход 11 г (81% от теоретического).
Строение бензола
Современная теория строения молекулы бензола базируется на представлении о гибридизации орбиталей атома углерода.
Учебный фильм «Строение молекулы бензола»
Согласно этой теории, атомы углерода в бензоле находятся в состоянии sp2-гибридизации.
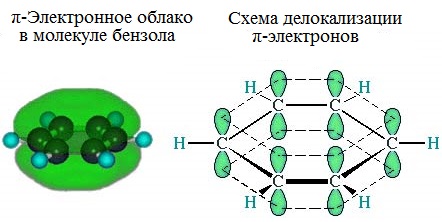
Каждый атом углерода образует три σ-связи (две с атомами углерода и одну – с атомом водорода). Валентные углы между каждой парой σ-связей равны 120°. Таким образом, все шесть атомов углерода и все σ-связи С-С и С-лежат в одной плоскости, образуя правильный шестиугольник (σ-скелет молекулы бензола).
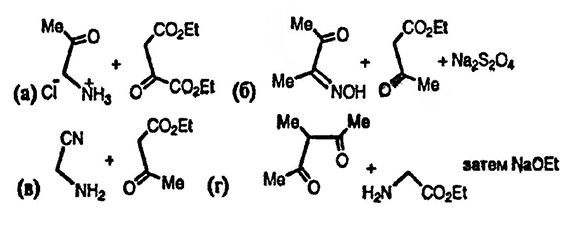
Каждый атом углерода имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. Все шесть р-электронов взаимодействуют между собой, образуя π-связи, не локализованные в пары, как при образовании обычных двойных связей, а образующие единое π-электронное облако и единую химическую связь для всех атомов углерода.
Таким образом, в молекуле бензола осуществляется круговое сопряжение, образуется единая сопряженная π-система. Наибольшая π-электронная плотность в этой сопряженной системе располагается над и под плоскостью σ-скелета.
Сочетание шести σ-связей с единой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
π-Электронное облако обусловливает сокращение расстояния между атомами углерода.
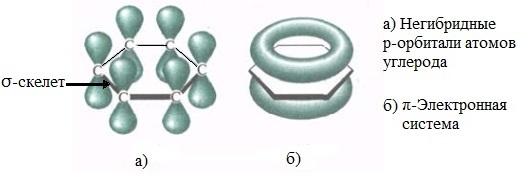
Все связи С-С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – «полуторная» – промежуточная между простой и двойной, так называемая ароматическая связь.
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) с окружностью внутри, обозначающего делокализованные π-связи.
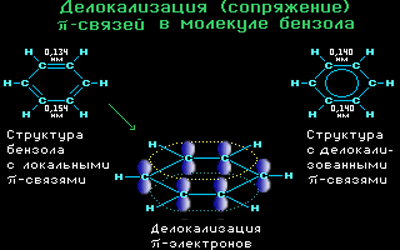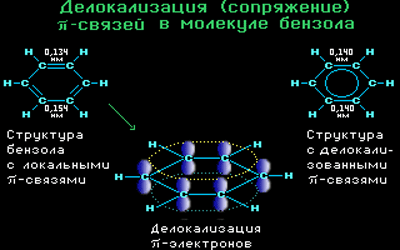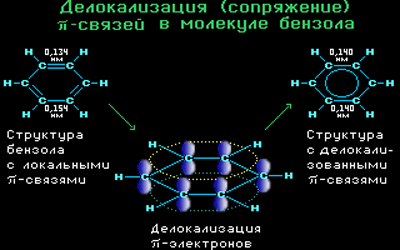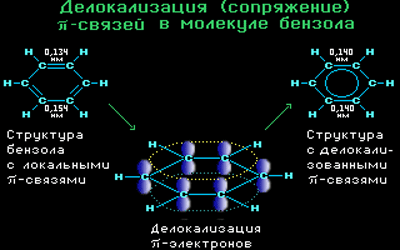
Такое электронное строение объясняет все особенности бензола. Становится понятно, почему бензол трудно вступает в реакции присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Таким образом, наряду с формулой Кекуле используется формула бензола, где обобщенное электронное облако изображают замкнутой линией внутри кольца.
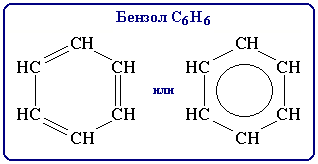
Рубрики: Арены Теги: Арены
Химия10 класс
§ 7. Арены. Бензол
Бензол С6Н6 является первым представителем аренов. Его можно получить тримеризацией ацетилена:
В больших количествах бензол получают переработкой каменного угля.
Ф. Кекуле предложил следующую структурную формулу бензола:
Несмотря на высокую степень непредельности молекулы бензола (по составу), он не дает характерных для алкенов и алкинов качественных реакций: не обесцвечивает бромную воду и раствор перманганата калия. Это связано с особым строением молекулы бензола, которое в настоящее время показывают следующей структурной формулой:
и подробно изучают в курсе органической химии для школ и классов естественнонаучного профиля. Для вас достаточно иметь общее представление о строении молекулы бензола, которое представлено на рисунке 25.
Рис 25. Масштабная модель молекулы бензола
Бензол — это бесцветная жидкость с резким характерным запахом, легче воды и нерастворима в ней. Бензол токсичен, поэтому работа с ним в условиях школы недопустима.
Рассмотрим химические свойства бензола.
Как и все углеводороды, бензол горит:

Пламя бензола коптящее из-за высокого содержания углерода в молекуле.
Бензол используют как добавку к моторному топливу, так как он повышает качество бензина. Однако количество добавляемого бензола строго регламентировано из-за его токсичности.
В силу особенностей строения молекулы бензол занимает как бы промежуточное положение между предельными углеводородами (алканами) и непредельными (алкенами), т. е. может вступать как в реакции замещения, так и в реакции присоединения. Однако, в отличие от алканов, реакции замещения с бензолом протекают легче, а реакции присоединения — труднее, чем у алкенов. Последние мы рассматривать не будем, остановимся лишь на реакциях замещения, так как в результате этих реакций образуются вещества, которые используют для производства практически важных продуктов.
Реакция хлорирования бензола протекает в присутствии катализатора:

Полученный продукт называют также фенилхлоридом, так как одновалентный радикал С6Н5 — называют фенилом.
Реакция нитрования — это взаимодействие бензола с азотной кислотой HNO3. Эта реакция протекает в присутствии концентрированной серной кислоты в качестве катализатора:
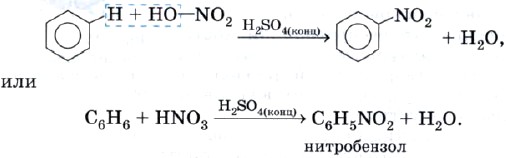
Полученный продукт называют нитробензолом. Почему нитробензолом? Потому что группу атомов — NO2 называют нитрогруппой.
Нитробензол — исходное вещество для получения анилина, который будет рассмотрен в § 16.
Области применения бензола показаны на рисунке 26.

Рис. 26. Применение бензола: 1 — добавка к бензину; 2 — производство растворителей; 3—7 — производство органических соединений {ацетона 3, анилина 4, пестицидов 5, лекарственных средств 6, фенолоформальдегидных пластмасс 7)
Новые слова и понятия
- Бензол.
- Получение бензола.
- Химические свойства бензола: горение, реакции замещения с хлором и азотной кислотой.
- Применение бензола.
Вопросы и задания
- Как вы думаете, при горении какого углеводорода — бензола или ацетилена — пламя будет более коптящим? Почему? Ответ подтвердите расчетами.
- Перечислите области применения бензола.
- Рассчитайте количество вещества ацетилена, который потребуется доя получения 400 мл бензола (плотность 0,8 г/мл).
-
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) метан→ацетилен→бензол→хлорбензол;
б) карбонат кальция→оксид кальция→карбид кальция→ацетилен→бензол→нитробензол.
- Бензол является прекрасным растворителем органических веществ и входит в состав многих бытовых препаратов-растворителей, например в состав «Сольвента», где его содержание составляет 25%. Рассчитайте массу бензола, которая необходима для изготовления 300 г «Сольвента».
Насколько опасен бензол
Бензол – это токсичное вещество. Проявление ощущения недомогания, которое сопровождается тошнотой и сильным головокружением – это признак отравления. Не исключается даже летальный исход. Чувство неописуемого восторга – это не менее тревожные звоночки при отравлении бензолом.
Бензол в жидком состоянии вызывает раздражение кожи. Бензольные пары с легкостью проникают даже через неповрежденный кожный покров. При самых недолгосрочных контактах с веществом в небольшой дозе, но на регулярной основе, неприятные последствия не заставят себя долго ждать. Это может быть поражение костного мозга и лейкозы острого характера разного вида.
Ко всему прочему, вещество вызывает зависимость у человека. Бензол действует как дурман. Из табачного дыма получается дегтеобразный продукт. Кода его изучили, то пришли к выводу, что содержание последнего небезопасно для человека. Обнаружилось помимо присутствия никотина еще и наличие ароматических углеводов вида бензпирена. Отличительной чертой бензпирена являются канцерогенные вещества. Действие они оказывают очень вредное. Например, вызывают онкологические заболевания.
Несмотря на вышесказанное, бензол является стартовым сырьем для производства разнообразных лекарственных препаратов, пластмасс, резины синтетического происхождения и, конечно же, красителей. Это самое распространённое детище химии и ароматическое соединение.
Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
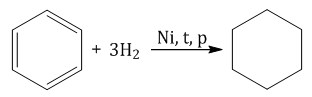
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
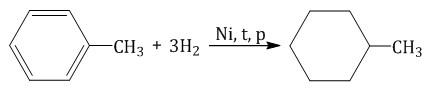
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
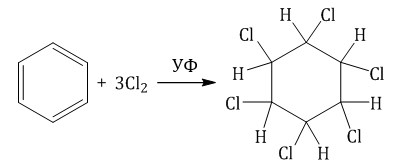
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
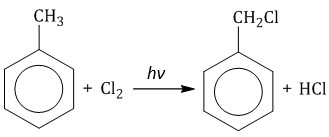
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
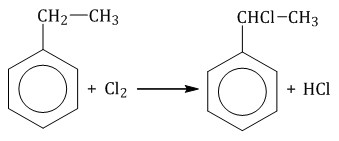
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Что такое бензол
Это органическое вещество, прозрачная жидкость со сладковатым запахом. По химической структуре относится к простейшим ароматическим углеводородам.
Основные естественные источники бензола в природе — каменный уголь и нефть. В лабораторных условиях возможна его полимеризация (образование) из ацетилена. Промышленные способы получения бензола — коксование из каменного угля, а также каталитический риформинг и пиролиз бензиновых фракций нефти.
Химическая формула бензола — C6H6. Это циклическая структура из шести атомов углерода была открыта в 1865 году немецким химиком Фридрихом Августом Кекуле. А впервые в чистом виде бензол был обнаружен ещё раньше — в 1825 г. английский физик Фарадей выделил его светильного газа.
Физические свойства бензола включают плохую растворимость в воде, смешиваемость с органическими растворителями, высокую степень воспламеняемости, горючесть, взрывоопасность. Его расплавление происходит при температуре 5,5–6,0 °C, испарение при 79,6–80,5 °C, кипение — 80,1 °C. Он легче воды, так как имеет низкую относительную плотность (0,88 г/см3). Является легкорастворимым в эфире и спирте веществом.
Химические свойства бензола обусловлены его принадлежностью к группе ненасыщенных углеводородов с циклической структурой. Поэтому ему типичны реакции окисления и замещения. Методика промышленной разработки была предложена немецким учёным Гофманом, выделившим вещество из каменноугольной смолы.
Бензол сильно ядовит. Токсическое действие происходит:
- ингаляционно — при вдыхании паров;
- трансдермально — при непосредственном контакте с кожей или слизистыми оболочками;
- перорально — при ошибочном употреблении жидкости внутрь.
Многие интересные факты о бензоле, связанные с изучением его структуры и свойств, сохранились и дошли до наших дней. Так, немецкий учёный Гофман, читая лекции студентам о физических свойствах углеводородов, всегда цитировал слова знакомой ему дамы, что запах бензола такой же, как у стираных перчаток. А идея кольцевой структуры бензола якобы пришла к химику Кекуле во сне — змея, состоящая из шести атомов углерода, свернулась в кольцо и укусила себя за хвост.
Что такое бензол — видеоурок
Химические свойства
Вследствие значительной устойчивости π-облака для бензола, в отличие от неароматических непредельных углеводородов, характерные реакции замещения, а не присоединения, поскольку они должны приводить к потере ароматичности, однако реакции присоединения также могут происходить за достаточно жестких условий. Замещение происходит электрофильным механизмом. Также бензол вступает в реакции окисления.
Реакции электрофильного замещения
Бензол вступает в реакции электрофильного замещения, происходящих по такому механизму: на первой стадии происходит образование π-комплекса между электрофилом (в форме катиона или сильно поляризованной молекулы E σ +-Nu σ-) и молекулой бензола, в результате перекрывания НСМО Электрофиль с ВЗМО ( π-облаком) бензола. После этого пара p-электронов выходит из сопряженного бензольного кольца и участвует в образовании σ-связи с электрофилом, таким образом π-комплекс превращается в σ-комплекс или интермедиат Уэлланда. Эта промежуточное соединение имеет положительный заряд и лишена ароматического характера, из-за чего менее устойчивой по сравнению с ароматическим кольцом, в которое обычно быстро превращается в результате отщепления протона (этот этап происходит через еще один промежуточный π-комплекс).
Алкилирование и ацилирование по Фриделем-Крафтса
Алкилирование бензола осуществляется алкилгалогенидами, алкенами и спиртами, ацилирование — карбоновыми кислотами, галогенангидриды и ангидридами, оба типа реакций катализируемых кислотами Льюиса. Эти реакции назван в честь их первооткрывателей Шарля Фриделя и Джеймса Крафтса.
Роль катализатора в этом типе реакций заключается в том, что он взаимодействует с алкилирующие или ацилюючим реагентом и обеспечивает образование карбкатион или поляризованного комплекса. Например, при взаимодействии Хлорметан и алюминий хлорида образуется комплекс с усиленной електрофильнистю атома углерода:
Примером реакции алкилирование может быть этилирования бензола хлорэтан.
Однако в промышленности етилбензен чаще получают реакцией с этиленом, которая также проходит в присутствии оксида алюминия, фосфорной или серной кислоты:
Продуктами реакций ацилирования бензола являются ароматические кетоны. Примером может быть реакция с ацетилхлоридом, продуктом которой является метиларилкетон:
Галогенирования
В отличие от ненасыщенных углеводородов бензол НЕ обесцвечивает бромную воду. Но для него характерны реакции галогенирования, происходящих по механизму электрофильного замещения, в присутствии кислот Льюиса. Например, при взаимодействии с бромом образуется бромбензол:
Нитрования
Характерной для бензола реакция нитрования использующая нитрующей смесь, которая состоит из концентрированной азотной кислоты и концентрированной серной кислоты как водоотнимающих средства. В этой реакции образуется нитробензен, что является предшественником в синтезе анилина
Сульфирование
При воздействии на бензол концентрированной серной кислоты происходит его сульфирования с образованием бензосульфоновои кислоты, может быть предшественником в синтезе фенола:
Реакции присоединения
Бензол вступает и в реакции присоединения, но значительно труднее, чем в реакции замещения. При этом он проявляет свойства непредельных углеводородов. Так, в присутствии никелевого катализатора и при нагревании происходит реакция гидрирования бензола с образованием циклогексана:
При этом атомы водорода присоединяются молекулой бензола за счет разрыва двойных связей. Бензол вступает также в реакцию присоединения одной, двух или трех молекул хлора. Эта реакция происходит свободнорадикальным механизмом для образования радикалов хлора необходимо ультрафиолетовый свет (достигается облучением ртутно-кварцевой лампой). Продуктом полного присоединения является гексахлорциклогексан:
Реакции окисления
На воздухе бензол горит сильно копоти пламенем, поскольку содержание углерода в нем значений. Смесь пары бензола с воздухом взрывная. Благодаря ароматическом характера бензол устойчив к воздействию окислителей: не окисляется раствором перманганата калия и азотной кислотой. В присутствии катализатора ванадий (V) оксида реагирует с молекулярным кислородом, в результате чего образуется малеиновый ангидрид:
Также бензол окисляется озоном, эта реакция исторически использовалась для установления его строения.
Профилактика
Класс опасности бензола — II по Стандарту ГОСТ 12.1.005–88 «Классификация вредных веществ и общие требования безопасности». Токсический эффект бывает как при кратковременном воздействии большого количества вещества, так и при длительном, хроническом влиянии в небольших дозах.
В связи с тем, что работа с бензолом опасна возможностью отравления, она строго регламентирована. Инструкция по технике безопасности содержит описание того, как хранить бензол, перечень правил работы с ним, указание предельно допустимой концентрации вещества. Содержать его необходимо в закрытой, маркированной таре на территории отапливаемых складских помещений.
 Предельная допустимая концентрация (ПДК) бензола в воздухе рабочей зоны должна находиться в пределах 5–15 мг/м3. При её превышении, в случае явной или предполагаемой утечки, аварийные работы проводят с использованием специальных средств защиты. К ним относятся — фильтрующий противогаз, фартук или защитный костюм из прорезиненной ткани, резиновые перчатки и сапоги, специальные кремы и пасты.
Предельная допустимая концентрация (ПДК) бензола в воздухе рабочей зоны должна находиться в пределах 5–15 мг/м3. При её превышении, в случае явной или предполагаемой утечки, аварийные работы проводят с использованием специальных средств защиты. К ним относятся — фильтрующий противогаз, фартук или защитный костюм из прорезиненной ткани, резиновые перчатки и сапоги, специальные кремы и пасты.
Таким образом, для предупреждения острых и хронических интоксикаций требуется выполнение следующих мер:
- соблюдение отраслевых стандартов оборудования рабочих помещений — герметизация аппаратуры, наличие вытяжных вентиляций, автоматизация процессов, связанных с опасным производством;
- контроль содержания бензола в воздухе рабочей зоны с помощью специальных датчиков;
- использование при работе с бензолом индивидуальных средств защиты — органов дыхания, кожи рук, глаз;
- применение эффективных средств очистки кожи;
- соблюдение техники безопасности;
- проведение медицинских осмотров для установления профессиональной пригодности;
- предоставление льгот, положенных при взаимодействии с вредными веществами — перерывы в работе, усиленное питание, льготный трудовой стаж, дополнительный отпуск;
- проведение ежегодных медицинских осмотров.
Подведём итоги. Бензол — это природное органическое соединение, которое является токсичным веществом. Вдыхание его паров, случайный приём внутрь или попадание на открытые участки кожи ведёт к отравлению. Обычно это случается при аварийных ситуациях на предприятиях или несчастных случаях в быту. При остром отравлении бензол оказывает нейротоксическое действие. При хронической интоксикации проявляется его гемотоксический эффект. Первоочерёдные меры при отравлениях направлены на исключение дальнейшего действия яда на организм. Лечение проводится в специализированных отделениях, которое заключается в нейтрализации и удалении яда, а также восстановление жизненно важных функций организма. Соблюдение мер профилактики помогает свести к минимуму количество несчастных случаев в быту и на производстве. Достоверная информация о токсичных свойствах бензола позволяет безопасно использовать это необходимое людям вещество.
Отравление бензолом
Действие на человека
Рассматривая бензол и его негативное влияние на организм, сначала следует разобраться с потенциальными группами риска. Чаще всего это те люди, которые работают в заводских условиях. Также в перечень попали все те, кто занимается его регулярными поставками, либо отвечает за его хранение, продукты переработки.
Кроме того в список попали:
- мойщики цистерн, в которых перевозился продукт;
- лаборанты на нефтеперерабатывающих станциях;
- рабочие по ремонту насосов;
- пострадавшие в пожарах, где выделилась значительное содержание продукта (зачастую это пластмассовые изделия, резиновая продукция).
Бензопропилен попадает в организм вместе с воздухом в виде паров. Именно этот способ считается наиболее частым при отравлениях таким веществом. На втором месте находится попадание через кожу.
Несмотря на его опасность, кратковременное вдыхание паров не принесет серьезного вреда. Но вот при длительном контакте с ядовитой средой или соприкосновении с концентрацией доз, превышающих нормы, это может закончиться проникновением составляющих искусственно созданного продукта в кровь. Выводится он посредством дыхания, через почки, либо в грудном молоке, если пострадавшей оказалась женщина в период лактации.
Если произошел контакт с кожей, то больной будет:
- ощущать сухость;
- появятся трещины;
- пораженный участок станет красным;
- начнется зуд;
- проявится отечность или высыпания пузырькового типа.
Схематически отравления можно разделить на две обширных группы:
- острое,
- хроническое.
В первом случае поражается по большей части дыхательная система, а также мозг и надпочечники. При втором раскладе сильнее всегда страдает кроветворная система.
Если воздействие на организм производится на регулярной основе, то все может завершиться:
- мутациями генов;
- сбоем функционирования репродуктивных органов;
- вредом для плода (имеется в виду влияние на беременных).
Помимо этого дополнительными побочными эффектами могут выступать периодические судороги, а также нарушение витаминного баланса группы В.