Постановление главного государственного санитарного врача рф от 16 июня 2003 г. n 144 «о введении в действие сп 2.1.7.1386-03» (с изменениями и дополнениями)
Содержание:
- Литература
- Классы сложных веществ
- Особенности химических реакций
- Краткая характеристика каждого класса органических соединений
- Классы токсичности (опасности) химических веществ по ГОСТ.
- Тривиальная
- Свойства вещества
- Порядок переработки отходов 1-4 класса опасности в 2020 году
- Вид опасности по свойствам
- Определение класса опасности[править]
- Цианистый калий
- Химические явления. Химическая реакция.
- Международная
- Категории опасности зданий
- Вещество в химии
- Классификация простых соединений
- Разнообразие веществ
Литература
- ГОСТ Р 22.0.05-94. Техногенные ЧС. Термины и определения.
- ГОСТ Р 22.9.05-95. Безопасность в ЧС. Комплексы средств индивидуальной защиты спасателей. Общие технические требования.
- ГОСТ 12.1.005-88. ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны. (ПДК для 1307 наименований веществ).
- ГОСТ 12.1.007-76 (99) Вредные вещества. Классификация и общие требования безопасности.
- Временный перечень СДЯВ.– М.: ШГО СССР, 1987.
- Директива НШ ГО СССР № 2 от 20.12.90 г. Перечень опасных химических продуктов, при нахождении которых на производстве либо на хранении выше установленных объёмов необходима разработка дополнительных мероприятий по защите населения на случай аварии с этими продуктами.
- Федеральный закон от 20.06.1997 г. № 116-ФЗ «О промышленной безопасности опасных производственных объектов».
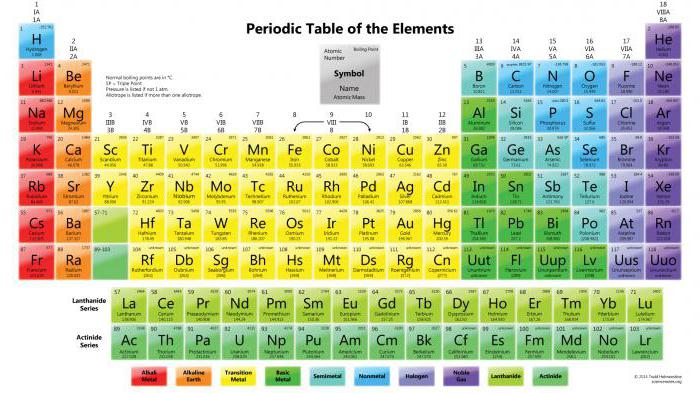
Классы сложных веществ
Систематизируя знания, объясняющие химические и физические свойства вещества, ученые разделили неорганические и органические соединения на классы. Оксиды, кислоты, соли и основания подробно изучаются на уроках химии в 7 – 9 классах, а классы органических веществ (углеводороды, спирты, альдегиды) введены в программу 10 – 11 классов.
Изучение классов химических соединений расширяет кругозор человека, способствует формированию реальной картины окружающего мира, состоящего из огромного разнообразия веществ. Так, рассматривая оксиды, мы узнаем не только о том, какое бывает вещество этого класса по своим физическим или химическим свойствам, но и знакомимся с распространением оксидов в природе, а также определяем их применение в промышленности и быту. Так, оксид силиция SiO2 входит в состав песка, глины, гранита, кварца, формируя литосферу Земли.
Он является важнейшим сырьем для промышленности строительных материалов, в производстве стекла, цемента, керамики. Оксиды железа FeO, Fe2O3, Fe3O4 являются основными компонентами различных видов железных руд, образующих месторождения, например, криворожское, курское, качканарское. В атмосфере широко представлены как оксиды углерода, в особенности углекислый газ, так и оксиды азота.
Особенности химических реакций
Все металлы, имеющие степень окисления 0, проявляют только свойства восстановителей. Щелочные и щелочноземельные элементы взаимодействуют с водой с образованием химически агрессивных оснований – щелочей:
2Na+2H20=2NaOH+H2
Типичная реакция металлов – окисление. В результате соединения с атомами кислорода, возникают вещества класса оксидов:
Zn+O2=ZnO
Это бинарные соединения, относящиеся к сложным веществам. Примерами основных окислов являются оксиды натрия Na2O, меди CuO, кальция CaO. Они способны ко взаимодействию с кислотами, в результате в продуктах обнаруживается соль и вода:
MgO+2HCl=MgCl2+H2O

Вещества классов кислот, оснований, солей относятся к сложным соединениям и проявляют разнообразные химические свойства. Например, между гидроксидами и кислотами происходит реакция нейтрализации, приводящая к появлению соли и воды. Состав солей будет зависеть от концентрации реагентов: так, при избытке в реагирующей смеси кислоты, получаются кислые соли, например, NaHCO3 – гидрокарбонат натрия, а высокая концентрация щелочи вызывает образование основных солей, таких как Al(OH)2Cl – дигидроксохлорид алюминия.
Краткая характеристика каждого класса органических соединений
- Предельные углеводороды (алканы) не способны к присоединению водорода и каких-либо другим элементов. Их общая формула — CnH2n+2. Простейший представитель алканов — метан (CH4). Все последующие соединения данного класса сходны с метаном по своему строению и свойствам, но отличны от него по составу на одну или несколько групп -CH2-. Такой ряд соединений, подчиняющихся данной закономерности, называется гомологическим. Алканы способны вступать в реакции замещения, горения, разложения и изомеризации (превращения в углероды разветвленного строения).
- Циклоалканы подобны алканам, но имеют циклическое строение. Их формула — CnH2n. Они могут участвовать в реакциях присоединения (например, водорода, становясь при этом алканами), замещения и дегидрирования (отнятия водорода).
- К непредельным углеводородам этиленового ряда (алкены) относят углеводороды с общей формулой CnH2n. Простейший представитель — этилен — C2H4. Они имеют в своем строении одну двойную связь. Вещества данного класса участвуют в реакциях присоединения, горения, окисления, полимеризации (процесс соединения малых одинаковых молекул в более крупные).
- Диеновые (алкадиены) углеводороды имеют формулу CnH2n-2. Они имеют уже две двойные связи и способны вступать в реакции присоединения и полимеризации.
- Ацетиленовые (алкины) отличаются от других классов обладанием одной тройной связи. Их общая формула — CnH2n-2. Простейший представитель — ацетилен — C2H2. Вступают в реакции присоединения, окисления и полимеризации.
- Ароматические углеводороды (арены) названы так по причине того, что некоторые из них обладают приятным запахом. Они имеют циклическое строение. Их общая формула — CnH2n-6. Простейший представитель — бензол — C6H6. Могут подвергаться реакциям галогенирования (замена атомов водорода атомами галогена), нитрования, присоединения и окисления.
Классы токсичности (опасности) химических веществ по ГОСТ.
- ГОСТ 12.1.007-76
- СанПиН 2.1.4.1074-01
| Показатель Отнесение вредного вещества к классу опасности производят по показателю, значение которого соответствует наиболее высокому классу опасности. |
Классы токсичности | |||
| I (чрезвычайно опасные) | II (высоко опасные) | III (умеренно опасные) | IV (мало опасные) | |
| ЛД 50 (пероральная), мг/кг Летальная доза 50 = средняя смертельная доза =гибель половины подопытных животных |
менее 15 | 15–150 | 151–5000 | более 5000 |
| ЛД 50 (кожная), мг/кг Летальная доза 50 = средняя смертельная доза =гибель половины подопытных животных |
менее 100 | 100–500 | 501–2500 | более 2500 |
| ЛС 50 (в воздухе), мг/м3 Летальная концентрация 50 = средняя смертельная концентрация = гибель половины подопытных животных |
менее 500 | 500–5000 | 5001–50000 | более 50000 |
| ПДК (в воздухе рабочей зоны), мг/м3 Предельно допустимая концентрация = Предельно допустимая концентрация загрязняющего вещества в атмосферном воздухе населенных мест — концентрация, не оказывающая в течение всей жизни прямого или косвенного неблагоприятного действия на настоящее или будущие поколения, не снижающая работоспособности человека, не ухудшающая его самочувствия и санитарно-бытовых условий жизни. Существуют также: среднесуточная ПДК и максимальная разовая ПДК. |
менее 0,1 | 0,1–1,0 | 1,0–10,0 | более 10 |
| КВИО Коэффициент возможности ингаляционного отравления= Отношение максимально достижимой концентрации вредного вещества в воздухе при 20 °С к средней смертельной концентрации вещества для мышей |
более 300 | 30–300 | 3–30 | менее 3,0 |
| Зона острого действия (Zac) Отношение средней смертельной концентрации вредного вещества к минимальной (пороговой) концентрации, вызывающей изменение биологических показателей на уровне целостного организма, выходящих за пределы приспособительных физиологических реакций |
менее 6,0 | 6–18 | 18–54 | более 54 |
| Зона хронического действия (Zch) Отношение минимальной (пороговой) концентрации, вызывающей изменение биологических показателей на уровне целостного организма, выходящих за пределы приспособительных физиологических реакций, к минимальной (пороговой) концентрации, вызывающей вредное действие в хроническом эксперименте по 4 ч, пять раз в неделю на протяжении не менее четырех месяцев |
более 10 | 5–10 | 5–2,5 | менее 2,5 |
| Зона биологического действия (Zbl) Отношение величины средней смертельной дозы (или концентрации) яда к величине его порога хронического действия. |
более 1000 | 100–1000 | 10–100 | менее 10 |
Тривиальная
Это самая первая номенклатура, появившаяся в начале развития органической химии, когда еще не было ни классификации веществ, ни теории строения их соединений. Органическим соединениям присваивались случайные названия по источнику получения. Например, яблочная кислота, щавелевая кислота. Также отличительными критериями, по которым давались названия, были цвет, запах и химические свойства. Однако последнее служило поводом редко, потому что в этот период времени было известно сравнительно мало информации о возможностях органического мира. Однако многие названия данной довольно старой и узкой номенклатуры часто применяются до сих пор. Например: уксусная кислота, мочевина, индиго (фиолетовые кристаллы), толуол, аланин, масляная кислота и многие другие.
Свойства вещества
Все вещества могут расширяться, сжиматься, превращаться в газ, жидкость или твёрдое тело. Их можно смешивать, получая новые вещества.
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры, химические свойства.
Агрегатные состояния
Основная статья: Агрегатное состояние
Почти все химические вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же химического вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками химических веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования химических веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
При переходе от идеальных моделей твёрдого, жидкого и газообразного состояний к реальным состояниям вещества обнаруживается несколько пограничных промежуточных типов, общеизвестными из которых являются аморфное (стеклообразное) состояние, состояние жидкого кристалла и высокоэластичное (полимерное) состояние. В связи с этим часто пользуются более широким понятием «фаза».
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизованное вещество, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
При некоторых условиях (обычно достаточно отличающихся от обычных) те или иные вещества могут переходить в такие особые состояния, как сверхтекучее и сверхпроводящее.
Порядок переработки отходов 1-4 класса опасности в 2020 году
Переработка веществ перечисленных по перечню выше классов опасности осуществляется на современном оборудовании, которое позволяет полностью или в максимальной мере устранить их химическую активность. В отдельных случаях становится возможным их вторичная переработка с последующим использованием в различных сферах
Обратите внимание, что сбор и утилизация отходов первого класса опасности осуществляется отдельно, они собираются в специальные контейнеры, которые обеспечивают безопасность их транспортировки. Этот контейнер имеет определенную форму, твердое покрытие внутри и подлежит перевозке в защитном чехле
Среди отходов второго класса только отработанные аккумуляторы нельзя подвергать механическому воздействию, а хранить и перемещать можно в оборудованных для этого контейнерах или поддонах. Также отдельно собираются нефтесодержащие отходы и отработанные масла.
Отходы классов опасности 1 и 2 запрещено бросать, ударять, переворачивать (в упакованном виде), а также повреждать тару, в которой они находятся. В ящиках с ртутьсодержащими элементами не допускается размещение иных отходов.
Сбор и утилизация отходов классов с первого по четвертый осуществляется в соответствии с инструкцией, где описана следующая последовательность действий:
- сбор и сортировка отходов;
- оформление документации;
- учет отходов;
- транспортировка к месту временного хранения, обезвреживания и переработки;
- уменьшение объема за счет применения инновационных технологий (упаковка, переработка).
Стоимость работы по определению принадлежности к определенному классу опасности отходов определяется в зависимости от их количества и компонентного состава. Информация об уровне вредоносности отходов заносится в специальный паспорт. В нем же перечислены основные физико-химические свойства отходов. Другие особенности заполнения паспорта перечислены в законе «Об отходах производства и потребления» от 24.06.1998.
Наша компания предлагает услуги по сбору, транспортировке и утилизации отходов 1-4 класса опасности. Мы имеем лицензию на выполнение данных видов услуг, используем только усовершенствованные современные технологии переработки, что позволяет минимизировать риски воздействия на окружающую среду, а также конкурентоспособные цены.
Вид опасности по свойствам
Деление элементов, обусловленное их физическими и химическими свойствами, осуществляется следующим образом:
— взрывчатые вещества;
— газы под давлением;
— воспламеняющиеся газы;
— вещества в аэрозольной упаковке;
— горючие жидкости;
— воспламеняющиеся твердые вещества;
— саморазлагающиеся материалы;
— пирофорные вещества (способные к самовозгоранию при непосредственном контакте с воздухом в течение 5 минут);
— самонагревающиеся материалы;
— окисляющие вещества (газы, способные вызвать воспламенение других веществ при контакте с ними);
— химикаты, способные при контакте с водой выделять воспламеняющиеся газы;
— органические пероксиды (перекиси);
— вещества, вызывающие коррозию металлов.

Согласно стандарту, любой элемент может иметь класс опасности химических веществ по разным категориям.
К примеру, газообразное вещество Х обладает такими видами опасности, как:
— газ под давлением;
— окисляющий элемент;
— коррозийное вещество;
— химикат, оказывающий острое токсическое воздействие на человека;
— вещество, вызывающее некроз тканей и действующее на орган зрения;
— элемент, который может оказывать острое токсическое воздействие на водную среду.
Определение класса опасности[править]
Экспериментальный методправить
Изначально экспериментальное определение токсикологических свойств веществ лежит в основе оценивания их класса опасности и других производных характеристик. Для большей точности оценку рекомендуется проводить на основании результатов исследований токсичности в отношении двух-трёх видов животных или тест-культур (штаммов и пр.).
Расчётный методправить
Расчётный метод основан на базе данных о токсикологических свойствах отдельных веществ в сочетании с достаточно полным аналитическим исследованием объекта (отхода). На практике применение расчётного метода связано с целым рядом сознательно не учитываемых ограничений, и применяется лишь ввиду высокой стоимости прямого токсикологического исследования объкта.
Компьютерные программы для расчета класса опасностиправить
В настоящее время существует несколько программ для расчета класса опасности отходов, в частности программа «определене Класса опасности отходов. Справочник отходов.», разработанная НПП «ЛОГУС» http://www.logus.ru/catalog/info135.htm
Цианистый калий
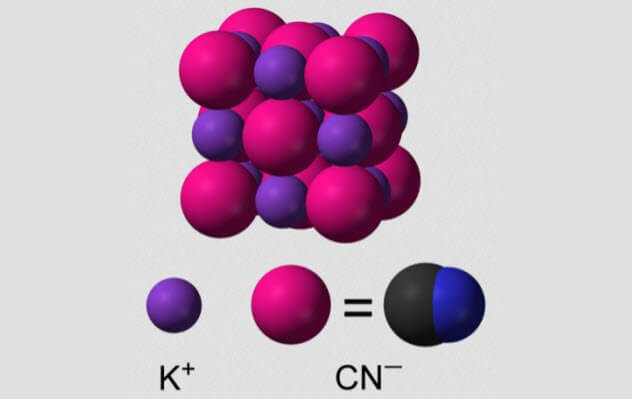
Один из гемопротеинов крайне полезен для нас: гемоглобин, белок, переносящий кислород в нашей крови. Цианид избавляет гемоглобин от способности перевозить кислород.
Когда цианистый калий вступает в контакт с водой, он разбивается на цианистый водород, который легко всасывается телом. Этот газ пахнет горьким миндалем, хотя не все могут его учуять.
Из-за быстрой реакции цианистый калий часто использовался как средство для многими людьми. Британские агенты времен Второй мировой войны носили таблетки цианида на случай поимки, и многие высокопоставленные нацисты также использовали капсулы цианистого калия, чтобы избегать правосудия.
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Международная
Ее полное название — систематическая международная номенклатура химических соединений ИЮПАК (IUPAC, International Unionof Pureand Applied Chemistry, Международного союза теоретической и прикладной химии). Она разработана и рекомендована съездами ИЮПАК в 1957 и 1965 годах. Правила международной номенклатуры, опубликованные в 1979 году, были собраны в «Синей книге» (BlueBook).
Фундаментом систематической номенклатуры химических соединений является современная теория строения и классификации органических веществ. Данная система ставить целью перед собой решение основной проблемы номенклатуры: наименование всех органических соединений должно включать в себя правильные названия заместителей (функций) и их опоры — углеводородного скелета. Оно должно быть таким, чтобы по нему можно было определить единственно верную структурную формулу.
Стремление создать унитарную химическую номенклатуру для органических соединений зародилось в 80-е годы XIX века. Это произошло после создания Александром Михайловичем Бутлеровым теории химического строения, в которой было четыре основных положения, рассказывающих о порядке атомов в молекуле, явлении изомерии, взаимосвязи строения и свойств вещества, а также о влиянии атомов друг на друга. Данное событие произошло в 1892 году на съезде ученых-химиков в Женеве, который утвердил правила номенклатуры органических соединений. Эти правила вошли в органику под названием Женевская номенклатура. На ее основе был создан популярный справочник Бейльштейна.
Естественно то, что со временем количество органических соединений росло. По этой причине и номенклатура все время усложнялась, и возникали новые дополнения, которые были озвучены и приняты на очередном съезде, состоявшемся в 1930 году в городе Льеже. Нововведения основывались на удобстве и лаконичности. И теперь систематическая международная номенклатура вобрала в себя некоторые положения как женевской, так и льежской.
Таким образом, в этих трех типах систематизации и заключаются основные принципы химической номенклатуры органических соединений.

Категории опасности зданий
Не стоит забывать про класс функциональной пожарной опасности. Что он под собой подразумевает? В зависимости от того, как именно используется здание, от того, какой опасности подвергаются люди, находящиеся внутри него, можно выделить разные категории, определяющие, насколько безопасно строение. Классы могут быть следующими:
- Класс функциональной пожарной опасности строения, которое не используется для постоянного проживания/пребывания в нем людей. Речь идет о дошкольных учреждениях, гостиницах, общежитиях, специализированных домах для инвалидов и престарелых людей. Это категория Ф1.
- Класс функциональной опасности строений зрелищного, культурно-просветительского характера. Речь идет о музеях, кинотеатрах, цирках, библиотеках, театрах и т.п. Это категория Ф2.
- Класс опасности зданий предприятий, которые специализируются на обслуживании населения. Разнообразные торговые компании, столовые и рестораны, медицинские заведения, вокзалы и т.д. Это категория Ф3.
- Класс опасности здания образовательного, научно-исследовательского, редакционно-издательского, информационного характера. В эту категорию так же входят пожарные депо и управленческие учреждения. Это класс Ф4.
- Класс опасности комнат складского типа (книгохранилища, склады, архивы и т.п.). Категория Ф5.
Вещество в химии
Основная статья: Химическое вещество
В химии веществом называется вид материи с определёнными химическими свойствами — способностью участвовать в химических реакциях определенным образом.
Все химические вещества состоят из частиц — атомов, ионов или молекул; при этом молекула может быть определена, как наименьшая частица химического вещества, обладающая всеми его химическими свойствами.
Фактически химические соединения могут быть представлены не только молекулами, но и другими частицами, которые могут менять свой состав.
Химические свойства веществ, в отличие от физических, не зависят от агрегатного состояния, таким образом лед и вода — одно и то же вещество с точки зрения химии.
Химическое вещество характеризуется своим составом и структурой, вещества с одним и тем же химическим составом, могут быть разными из-за разной структуры — например, белый фосфор и чёрный фосфор.
Классификация простых соединений
Теперь пришло время ознакомиться с самым интересным: классификацией как органических, так и неорганических веществ.
Сейчас миру известны тысячи различных неорганических соединений. Знать все их названия, формулы и свойства практически невозможно. Поэтому все вещества неорганической химии разделены на классы, группирующие все соединения по сходному строению и свойствам. Такая классификация представлена в таблице ниже.
| Неорганические вещества | |
| Простые | Металлические (металлы) |
| Неметаллические (неметаллы) | |
| Амфотерные (амфигены) | |
| Благородные газы (аэрогены) | |
| Сложные | Оксиды |
| Гидроксиды (основания) | |
| Соли | |
| Бинарные соединения | |
| Кислоты |
Для первого разделения использовалось то, из скольких элементов состоит вещество. Если из атомов одного элемента, то оно простое, а если из двух и более — сложное.
Рассмотрим каждый класс простых веществ:
- Металлами называют элементы, расположенные в первой, второй, третьей группах (кроме бора) периодической таблицы Д. И. Менделеева, а также элементы декад, лантоноиды и октиноиды. Все металлы обладают общими физическими (ковкостью, тепло- и электропроводностью, металлическим блеском) и химическими (восстановительные, взаимодействие с водой, кислотой и так далее) свойствами.
- К неметаллам относят все элементы восьмой, седьмой, шестой (кроме полония) групп, а также мышьяк, фосфор, углерод (из пятой группы), кремний, углерод (из четвертой группы) и бор (из третьей).
- Амфотерные соединения — это такие соединения, которые могут проявлять свойства как неметаллов, так и металлов. Например, алюминий, цинк, бериллий и так далее.
- К благородным (инертным) газам относятся элементы восьмой группы: радон, ксеон, криптон, аргон, неон, гелий. Их общее свойство — малая активность.
Так как все простые вещества состоят из атомов одного и того же элемента Периодической системы, то их названия обычно совпадают с названиями этих химических элементов таблицы.
Чтобы различать понятия «химический элемент» и «простое вещество», несмотря на схожесть названий, нужно понимать следующее: при помощи первого образуется сложное вещество, оно связывается с атомами других элементов, его нельзя рассматривать отдельно от какого-либо сложного вещества. Второе же понятие дает нам знать, что это вещество имеет свои свойства, не связываясь с другими. Например, есть кислород, входящий в состав воды, а есть кислород, которым мы дышим. В первом случае элемент как часть целого — воды, а во втором — как само по себе вещество, которым дышит организм живых существ.

Теперь рассмотрим каждый класс сложных веществ:
- Оксидами называется сложное вещество, состоящее из двух элементов, одним из которых является кислород. Оксиды бывают: основными (при растворении в воде из них образуются в основания), амфотерными (образованы при помощи амфотерных металлов), кислотными (образованы неметаллами в степенях окисления от +4 до +7), двойные (образованы с участием металлов в разных окислительных степенях) и несолеобразующие (например, NO, CO, N2O и другие).
- К гидроксидам относят вещества, имеющие в своем составе группу — OH (гидроксильную группу). Они бывают: основными, амфотерными и кислотными.
- Солями называются такие сложные соединения, в состав которых входит катион металла и анион кислотного остатка. Соли бывают: средними (катион металла + анион кислотного остатка); кислыми (катион металла + незамещенный(ые) атом(ы) водорода + кислотный остаток); основными (катион металла + кислотный остаток + гидроксильная группа); двойными (два катиона металла + кислотный остаток); смешанными (катион металла + два кислотных остатка).
- Бинарное соединение представляет собой двухэлементное соединение или многоэлементное, включающее не более одного катиона, или аниона, или сложного катиона, или аниона. Например, KF, CCl4, NH3 и так далее.
- К кислотам относятся такие сложные вещества, катионами которых являются исключительно ионы водорода. Их отрицательные анионы называются кислотными остатками. Данные сложные соединения могут быть кислородосодержащими или бескислородными, одноосновными или двуосновными (в зависимости от числа атомов водорода), сильными или слабыми.
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.