Бромистый водород
Содержание:
ссылки
- Корпорация Интерскан. (2017). Приборы для мониторинга бромистого водорода и бромистого водорода. Получено с gasdetection.com.
- Химический паспорт. (2016). Получено из БРОМИДА ВОДОРОДА, БЕЗВОДНЫЙ: cameochemicals.noaa.gov.
- Эгон Виберг, Н. В. (2001). Неорганическая химия Академическая пресса.
- Бромистый водород. (2016). Получено из ChemicalBook.
- Водород: бромистый водород. (1993-2016). Получено из WebElements.
- Паспорт безопасности материала Бромистый водород. (2005, 9 октября). Получено с sciencelab.com.
- Национальный центр биотехнологической информации. (S.F.). База данных PubChem Compound; CID = 260. Получено из pubchem.ncbi.nlm.nih.gov.
- Praxair Inc. (2016, 17 октября). Бромистый водород, безводный паспорт безопасности P-4605. Получено с сайта praxair.com.
- ШОВА ДЕНКО К.К. (Н.Д.). бромистый водород. Получено с www.sdk.co.jp.
Важнейшие соединения:
Бромоводород HBr — ядовитый бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. Хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода. Раствор — сильная одноосновная бромоводородная кислота. Соли — бромиды бесцветные кристаллы, хорошо растворимые в воде (нерастворим AgBr, бледно-желтого цвета).
Оксид брома(I) Br2O., газ коричневого цвета. Образуется при действии брома на HgO в CCl4. Свойства …Бромноватистая кислота HBrO— сильный окислитель. Образуется при растворении брома в воде, под действием света разлагается на HBr и кислород; обладает слабыми кислотными свойствами, существует только в растворе. Соли — гипобромиты, KBrO, NaBrO — получены в свободном состоянии в виде кристаллогидратов. Все они очень неустойчивы, при нагревании (или подкислении растворов) распадаются на бромид и бромат: 3КВrO = 2KBr + KBrO3Бромиты, соли неизвестной даже в растворе бромистой кислоты HBrO2 — образуются при окислении гипобромитов бромом в щелочной среде: Ba(BrO)2 + 2Br2 + 4KOH = Ba(BrO2)2 + 4KBr + 2H2OБромноватая кислота, HBrO3 — концентрированный раствор представляет собой бесцветную сиропоообразную жидкость.
Соли — броматы. Бромноватая кислота и броматы являются сильными окислителями:
2S + 2NaBrO3 = Na2SO4 + Br2+ SO2Бромная кислота HBrO4 существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO4 — самый сильный окислитель среди кислородных кислот брома, реакции с ее участием протекают очень медленно. Трехфторид брома, BrF3 — красная жидкость с т. кип. 126°C , образуется в результате прямой реакции брома с фтором. С водой и органическими веществами взаимодействует со взрывом. По отношению к неорганическим соединениям ведет себя как сильный фторирующий агент.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности как паров брома, так и жидкого брома, его следует хранить в стеклянной, плотно закупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
По реакции, указанной ниже, целесообразно посыпать проливы брома карбонатом натрия:
-
- 3Br2+3Na2CO3→5NaBr+NaBrO3+3CO2↑{\displaystyle {\mathsf {3Br_{2}+3Na_{2}CO_{3}\rightarrow 5NaBr+NaBrO_{3}+3CO_{2}\uparrow }}}
либо влажной пищевой содой:
-
- 6NaHCO3+3Br2→5NaBr+NaBrO3+6CO2↑+3H2O{\displaystyle {\mathsf {6NaHCO_{3}+3Br_{2}\rightarrow 5NaBr+NaBrO_{3}+6CO_{2}\uparrow +3H_{2}O}}}
Однако реакция элементарного брома с содой носит сильно экзотермический характер, что ведёт к увеличению испарения брома, к тому же выделяющаяся углекислота также способствует испарению, поэтому пользоваться вышеописанными методами не рекомендуется[источник не указан 980 дней]. Лучше всего[источник не указан 980 дней] для дегазации брома подходит водный раствор тиосульфата натрия Na2S2O3. Для локализации больших проливов брома можно использовать раствор тиосульфата натрия с добавками пенообразующих веществ и аэросила. Этот же раствор (3—5 % тиосульфат натрия) используется для смачивания ватно-марлевых повязок, которые помогают защитить органы дыхания от паров брома.
Кислородные соединения брома
Продолжим изучение вопроса, что такое бром. Взаимодействие галогена с холодной водой приводит к получению бромноватистой кислоты HBrO. Она является более слабой, чем соединение хлора, за счет снижения ее окислительных свойств. Еще одно соединение – бромноватая кислота, может быть получено путем окисления бромной воды хлором. Ранее в химии считали, что у брома не может быть соединений, в которых он мог бы проявлять степень окисления +7. Однако окислением бромноватого калия была получена соль – бромат калия, а из нее – и соответствующая кислота – HBrO4. Ионы галогенов имеют восстановительные свойства: при действии молекул HBr на металлы последние окисляются катионами водорода. Поэтому с кислотой взаимодействуют только те металлические элементы, которые стоят в ряду активности до водорода. В результате реакции образуются средние соли – бромиды, и выделяется свободный водород.
приложений
Приготовление бромидов
Бромидные соли могут быть получены, если HBr (ac) реагирует с гидроксидом металла. Например, производство бромида кальция считается:
Ca (OH)2 + 2HBr => CaBr2 + H2О
Другой пример для бромида натрия:
NaOH + HBr => NaBr + H2О
Таким образом, многие из неорганических бромидов могут быть получены.
Синтез алкилгалогенидов
А как насчет органических бромидов? Это броморганические соединения: RBr или ArBr.
Обезвоживание спиртов
Сырьем для их получения могут быть спирты. При протонировании кислотностью HBr они образуют воду, которая является хорошей исходящей группой, и вместо этого включается объемный атом Br, который становится ковалентно связанным с углеродом:
ROH + HBr => RBr + H2О
Эту дегидратацию проводят при температуре выше 100 ° C, чтобы облегчить разрыв связи R-OH2+.
Добавление к алкенам и алкинам
Молекула HBr может быть добавлена из ее водного раствора к двойной или тройной связи алкена или алкина:
R2C = CR2 + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Можно получить несколько продуктов, но в простых условиях продукт сначала образуется там, где бром связан с вторичным, третичным или четвертичным углеродом (правило Марковникова)..
Эти галогениды вмешиваются в синтез других органических соединений, и диапазон их применения очень широк. Кроме того, некоторые из них могут даже использоваться в синтезе или разработке новых лекарств..
Эфирный кливаж
Из простых эфиров можно получить два алкилгалогенида одновременно, каждый из которых несет одну из двух боковых цепей R или R ‘исходного эфира R-O-R’. Случается что-то похожее на обезвоживание спиртов, но механизм его реакции другой.
Реакция может быть схематизирована с помощью следующего химического уравнения:
ROR ‘+ 2HBr => RBr + R’Br
И вода тоже выделяется.
Его кислотность такова, что он может быть использован в качестве эффективного кислотного катализатора. Вместо добавления аниона Br- к молекулярной структуре, открывает путь для другой молекулы, чтобы сделать это.
Биологическая роль и токсичность соединений брома.
Многие аспекты биологической роли брома в настоящее время еще не выяснены. В организме человека бром участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Некоторые исследователи полагают, что соединения брома участвуют в деятельности эозинофилов – клеток иммунной системы. Пероксидаза эозинофилов окисляет бромид-ионы до бромноватистой кислоты, которая помогает разрушать чужеродные клетки, в том числе и раковые. Недостаток брома в пище приводит к бессоннице, замедлению роста и уменьшению числа эритроцитов в крови. Ежедневное поступление брома в организм человека с пищей составляет 2–6 мг. Особенно богаты бромом рыба, злаки и орехи.
Элементный бром ядовит. Жидкий бром вызывает трудно заживающие ожоги, при попадании на кожу его нужно смыть большим количеством воды или раствора соды. Пары брома в концентрации 1мг/м3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м3) – удушье и смерть. При отравлении парами брома рекомендуется вдыхать аммиак. Токсичность соединений брома менее велика, тем не менее, при длительном употреблении бромсодержащих препаратов может развиться хроническое отравление – бромизм. Его симптомы – общая вялость, появление сыпи на коже, апатия, сонливость. Бромид-ионы, поступая в организм в течение длительного времени, препятствуют накоплению иода в щитовидной железе, угнетая ее деятельность. Для ускорения выведения брома из организма назначают диету с большим содержанием соли и обильное питье.
Физико-химические свойства
Молекулярный вес
80 972 г / моль Обратите внимание, что, как упоминалось в предыдущем разделе, рассматривается только HBr, а не молекула воды. Если молекулярный вес взят из формулы Br-H3О+ он будет иметь значение примерно 99 г / моль
Внешний вид
Бесцветная или бледно-желтая жидкость, которая будет зависеть от концентрации растворенного HBr. Чем оно более желтое, тем более концентрированным и опасным оно будет.
плотность
1,49 г / см3 (водный раствор при 48% мас. / мас.). Эта величина, как и те, которые соответствуют точкам плавления и кипения, зависит от количества HBr, растворенного в воде.
Растворимость в воде
-221 г / 100 мл (при 0 ºC).
-204 г / 100 мл (15 ºC).
-130 г / 100 мл (100 ºC).
Эти значения относятся к газообразному HBr, а не к бромистоводородной кислоте. Как видно, повышение температуры снижает растворимость HBr; поведение, которое является естественным в газах. Следовательно, если требуются концентрированные растворы HBr (ac), лучше работать с ними при низких температурах..
При работе при высоких температурах HBr будет выходить в виде газообразных двухатомных молекул, поэтому реактор должен быть герметично закрыт для предотвращения утечки.
Применение
В химии
- Вещества на основе брома широко применяются в органическом синтезе.
- «Бромная вода» (водный раствор брома) применяется как реагент для качественного определения непредельных органических соединений.
Промышленное применение
Значительная часть элементарного брома до начала 1980-х использовалась для производства 1,2-дибромэтана, входившего в состав этиловой жидкости — антидетонирующей добавки в бензины, содержащей тетраэтилсвинец; дибромэтан в этом случае служил источником брома для образования относительно летучего дибромида свинца для предотвращения осаждения твёрдых оксидов свинца на деталях двигателя.
Бром также используется в синтезе антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
- Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
- Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
- Растворы бромидов используются в нефтедобыче.
- Растворы бромидов тяжёлых металлов используются как «тяжёлые жидкости» при обогащении полезных ископаемых методом флотации.
- Многие броморганические соединения применяются как инсектициды и пестициды.
Нахождение в природе
Ампула с бромом внутри акрилового куба
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br). Собственных минералов брома мало ещё и потому, что его ионный радиус очень большой и ион брома не может надёжно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде солёных озёр, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
В качестве исходного сырья для производства брома служат:
- морская вода (65 мг/л),
- рассолы соляных озёр,
- щёлок калийных производств,
- подземные воды нефтяных и газовых месторождений.
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
- H2+Br2→200−400oC,Pt2HBr{\displaystyle {\mathsf {H_{2}+Br_{2}{\xrightarrow {200-400^{o}C,Pt}}2HBr}}}
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
- PBr3+3H2O⟶H3PO3+3HBr{\displaystyle {\mathsf {PBr_{3}+3H_{2}O\longrightarrow H_{3}PO_{3}+3HBr}}}
- PBr5+4H2O⟶H3PO4+5HBr{\displaystyle {\mathsf {PBr_{5}+4H_{2}O\longrightarrow H_{3}PO_{4}+5HBr}}}
Восстановление брома несколькими способами:
- 3Br2+S+4H2O→100−150oCH2SO4+6HBr{\displaystyle {\mathsf {3Br_{2}+S+4H_{2}O{\xrightarrow {100-150^{o}C}}H_{2}SO_{4}+6HBr}}}
- Br2+KNO2+H2O→ KNO3+2HBr{\displaystyle {\mathsf {Br_{2}+KNO_{2}+H_{2}O{\xrightarrow {\ }}KNO_{3}+2HBr}}}
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
- KBr+H2SO4→H2OKHSO4+HBr↑{\displaystyle {\mathsf {KBr+H_{2}SO_{4}{\xrightarrow {H_{2}O}}KHSO_{4}+HBr\uparrow }}}
Физико-химические свойства
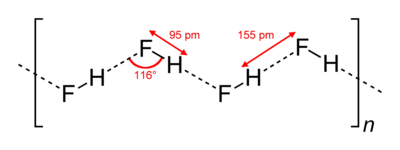
Бромистый водород — бесцветный газ при комнатной температуре с кислым и раздражающим запахом. Соединение стабильно, но постепенно темнеет при воздействии воздуха или света, как показано на рисунке 2 (Национальный центр биотехнологической информации, S.F.).
Он имеет молекулярную массу 80,91 г / моль и плотность 3,307 г / л, что делает его тяжелее воздуха. Газ конденсируется с образованием бесцветной жидкости с температурой кипения -66,73 градусов по Цельсию..
Продолжая охлаждаться, жидкость затвердевает, получая белые кристаллы, температура плавления которых составляет -86,82 градуса Цельсия с плотностью 2,603 г / мл (Egon Wiberg, 2001). Внешний вид этих кристаллов иллюстрируется на фиг.3.
Расстояние соединения между бромом и водородом составляет 1,414 ангстрем, а его энергия диссоциации составляет 362,5 кДж / моль..
Бромистый водород более растворим в воде, чем хлористый водород, он способен растворять 221 г в 100 мл воды при температуре 0 градусов Цельсия, что эквивалентно объему 612 литров этого газа на каждый литр воды. Он также растворим в спирте и других органических растворителях..
В водном растворе (бромистоводородной кислоте) кислотные свойства HBr являются доминирующими (как в случае HF и HCl), и в связи водород-галоген он слабее в случае бромистого водорода, чем в хлористый водород.
Поэтому, если хлор пропускают через бромистый водород, наблюдается образование коричневых паров, характерных для молекулярного брома. Это объясняет следующая реакция:
2HBr + Cl2 → 2HCl + Br2
Это свидетельствует о том, что бромистый водород является более сильным восстановителем, чем хлористый водород, и что хлористый водород является лучшим окислителем.
Бромистый водород — сильная безводная кислота (без воды). Быстро и экзотермически реагирует с основаниями всех типов (включая амины и амиды).
Экзотермически реагирует с карбонатами (включая известняк и строительные материалы, содержащие известняк) и гидрокарбонатами с образованием углекислого газа.
Реагирует с сульфидами, карбидами, боридами и фосфидами с образованием токсичных или легковоспламеняющихся газов.
Реагирует со многими металлами (включая алюминий, цинк, кальций, магний, железо, олово и все щелочные металлы) с образованием легковоспламеняющегося газообразного водорода.
Бурно ответить с:
- уксусный ангидрид
- 2-аминоэтанол
- гидроксид аммония
- фосфид кальция
- хлорсульфоновая кислота
- 1,1-дифторэтилен
- этилендиамин
- полиэтиленимина
- дымящая серная кислота
- хлорная кислота
- б-пропиолактон
- оксид пропилена
- перхлорат серебра
- Фосфид урана (IV)
- винилацетат
- карбид кальция
- карбид рубидия
- ацетилид цезия
- ацетилид рубидия
- борид магния
- сульфат ртути (II)
- фосфид кальция
- карбид кальция (Химическая карта данных, 2016).
Реактивность и опасности
Бромистый водород классифицируется как разъедающее и раздражающее соединение. Это чрезвычайно опасно в случае контакта с кожей (раздражающим и вызывающим коррозию) и глазами (раздражающим) и в случае проглатывания и вдыхания (раздражение легких).
Состав хранится в герметичных контейнерах со сжиженным газом. Длительное воздействие огня или сильного нагрева может привести к сильному разрыву контейнера под давлением, который может выстрелить, выделяя раздражающие токсичные пары..
Длительное воздействие низких концентраций или кратковременное воздействие высоких концентраций может привести к неблагоприятным последствиям для здоровья при вдыхании.
В результате термического разложения безводного бромистого водорода образуются токсичные газы брома. Это может стать легковоспламеняющимся, если это реагирует, выпуская водород. При контакте с цианидом образуются токсичные газы из цианистого водорода.
Вдыхание вызывает сильное раздражение носа и верхних дыхательных путей, которое может вызвать повреждение легких.
Проглатывание вызывает ожоги рта и желудка. Попадание в глаза вызывает сильное раздражение и ожоги. Контакт с кожей вызывает раздражение и ожоги.
Если это химическое вещество в растворе попало в глаза, их следует немедленно промыть большим количеством воды, иногда поднимая нижнее и верхнее веко.
При работе с этим химикатом не следует носить контактные линзы. Если ткань глаза замерзла, вам следует немедленно обратиться к врачу.
Если ткань не замерзла, немедленно и полностью промойте глаза большим количеством воды в течение не менее 15 минут, периодически поднимая нижнее и верхнее веко.
Если раздражение, боль, отек или слезы не проходят, обратитесь к врачу как можно скорее..
Если это химическое вещество в растворе попадет на кожу и не замерзнет, немедленно промойте кожу, загрязненную водой..
Если это химическое вещество проникает в одежду, немедленно снимите одежду и промойте кожу водой.
В случае обморожения немедленно обратитесь к врачу. Не трите пораженные участки и не промывайте их водой. Чтобы не допустить дальнейшего повреждения тканей, не пытайтесь удалять замерзшую одежду из областей с морозом..
При вдыхании большого количества этого химического вещества человека, подвергшегося воздействию, следует немедленно вывести на свежий воздух. Если дыхание прекратилось, выполните реанимацию из уст в уста. Пострадавший должен быть в тепле и покое, в дополнение к попыткам получить медицинскую помощь как можно скорее.
Если это химическое вещество в растворе проглотили, немедленно обратитесь к врачу
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г на 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
-
- Br2+H2O→HBr+HBrO{\displaystyle {\mathsf {Br_{2}+H_{2}O\rightarrow HBr+HBrO}}}
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
-
- Br2+2KI→I2↓+2KBr{\displaystyle {\mathsf {Br_{2}+2KI\rightarrow I_{2}\downarrow +2KBr}}}
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
-
- Cl2+2KBr→Br2+2KCl{\displaystyle {\mathsf {Cl_{2}+2KBr\rightarrow Br_{2}+2KCl}}}
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Жидкий бром легко взаимодействует с золотом, образуя трибромид золота AuBr3:
-
- 2Au+3Br2→2AuBr3{\displaystyle {\mathsf {2Au+3Br_{2}\rightarrow 2AuBr_{3}}}}
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
-
- C2H4+Br2→C2H4Br2{\displaystyle {\mathsf {C_{2}H_{4}+Br_{2}\rightarrow C_{2}H_{4}Br_{2}}}}
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через неё газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
-
- 3Br2+3Na2CO3→5NaBr+NaBrO3+3CO2{\displaystyle {\mathsf {3Br_{2}+3Na_{2}CO_{3}\rightarrow 5NaBr+NaBrO_{3}+3CO_{2}}}}
Реагирует с родановодородом
-
- HSCN+Br2→BrCN+HBr+S↓{\displaystyle {\mathsf {HSCN+Br_{2}\rightarrow BrCN+HBr+S\downarrow }}}
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Биологическое значение
2-Октил-4-бром-3-оксобутаноат, соединение органотромина, обнаруженное в спинномозговой жидкости млекопитающих
В 2014 году исследование показало, что бром (в форме бромид-иона) является необходимым кофактором в ходе биосинтеза коллагена IV, делая элемент существенным в архитектуре базальной мембраны и развитии тканей у животных. Тем не менее, не было отмечено никаких чётких симптомов или синдромов дефицита при полном удалении брома из пищи. В других биологических функциях бром может не быть необходимым, но всё же приносить пользу, особенно когда он заменяет хлор. Например, в присутствии перекиси водорода H2O2 синтезируемая эозинофилами с ионами хлорида или бромида эозинофильная пероксидаза обеспечивает мощный механизм, с помощью которого эозинофилы убивают многоклеточных паразитов (таких, как, например, нематодные черви, участвующие в филяриозе) и некоторые бактерии, такие как бактерии туберкулёза). Эозинофильная пероксидаза — это галопероксидаза, которая более эффективно использует бром, а не хлор для этой цели, производя гипобромит (бромводородную кислоту), хотя использование хлорид-иона также возможно. Хотя α-галоэфиры, как правило, считаются высокореактивными и, следовательно, токсичными промежуточными продуктами в биоорганическом синтезе, млекопитающие, включая людей, кошек и крыс, по-видимому, биосинтезируют следы α-бромэфира, 2-октил-4-бром-3-оксобутаноата, которые присутствуют в их спинномозговой жидкости и, вероятно, играют пока неясную роль в возникновении быстрого сна.
Морские организмы являются основным источником броморганических соединений, и именно в этих организмах роль брома могла бы быть намного более высокой. Более 1600 таких броморганических соединений были идентифицированы к 1999 году. Наиболее распространённым является метилбромид (CH3Br), около 56 000 тонн которого синтезируется за год морскими водорослями. Эфирное масло гавайской водоросли Asparagopsis taxiformis состоит из 80 % бромоформа. Большинство таких броморганических соединений в море синтезируется водорослями под действием уникального фермента, ванадийбромпероксидазы.
приложений
HBr используется в производстве органических бромидов, таких как бромистый метил, бромэтан и т. Д., И неорганических веществ, таких как бромид натрия, бромид калия, бромид лития и бромид кальция и т. Д..
Он также используется в фотографических и фармацевтических целях или для синтеза седативных и анестетиков. Кроме того, он применяется в промышленной сушке, отделке текстиля, покрытиях, обработке поверхности и огнезащитных средствах..
Это соединение также используется для травления листов поликремния, для изготовления компьютерных чипов (Interscan Corporation, 2017).
Бромистый водород является хорошим растворителем для некоторых металлических минералов, используемых при рафинировании металлов высокой чистоты..
В нефтяной промышленности он используется в качестве разделения алкокси и фенокси соединений и катализатора для окисления циклических углеводородов и углеводородов в цепи до кетонов, кислот или перекисей. Это также используется в синтетических красителях и специях.
Высококачественный газообразный HBr используется для сжигания и очистки полупроводникового сырья (SHOWA DENKO K.K, s.f.).
Соединение используется в качестве аналитического реагента при определении серы, селена, висмута, цинка и железа., Для отделения олова от мышьяка и сурьмы. Это катализатор алкилирования и восстановитель, используемый в органическом синтезе..
Бромистый водород можно использовать для производства бромистоводородной кислоты. Бромистоводородная кислота — очень сильная минеральная кислота, более сильная, чем соляная кислота.
HBr обладает высокой реакционной способностью и вызывает коррозию большинства металлов. Кислота является распространенным реагентом в органической химии, используется для окисления и катализа. Он также эффективен при извлечении некоторых металлических минералов (Бромистый водород, 2016).